题目内容
【题目】饮用水中NO3- 达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3 -的浓度,某兴趣小组提出如下方案:
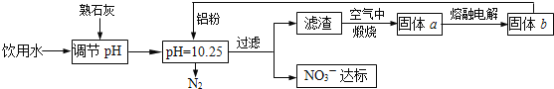
请回答下列问题:
(1)该方案中选用熟石灰调节 pH,理由是_______、__________、________, 在调节pH时,若pH过大或过小都会造成________的利用率降低。
(2)已知过滤后得到的滤渣是Al和Al(OH)3,则在溶液中铝粉和NO3-反应的离子方程式为____________________________________。
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物 均可参与大气循环,则催化还原法的离子方程式为____________________________________。
(4)饮用水中的NO3-主要来自于NH4+。已知在微生物作用下,NH4+经过两步反应被氧化 成NO3-。两步反应的能量变化示意图如下:
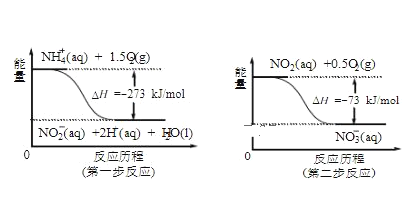
试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是__________________________。
【答案】引入的Ca2+对人体无害 来源丰富 价格便宜(意思相近均给分) 铝(或Al) 10Al+6NO3- +18H2O=10Al(OH)3↓+3N2↑+6OH- 5H2+2NO3-  N2↑+4H2O+2OH- NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)△H=-346kJ· mol-1
N2↑+4H2O+2OH- NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)△H=-346kJ· mol-1
【解析】
(1)选用熟石灰调节pH,原料来源丰富,价格便宜,且引人离子对人体无害,注意pH过大或过小,都将直接发生Al与酸或碱的反应;
(2)铝粉与硝酸根离子发生氧化还原反应生成固体,则固体为氢氧化铝,则硝酸被还原为氮气;
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气;
(4)由图可知,第一步热化学反应为NH4+(aq)+1.5O2(g)=2H+(aq)+NO2-(aq)+H2O(l) △H=-2736 kJ·mol-1,第二步热化学反应为NO2-(aq)+0.5O2(g)=NO3-(aq))△H=-73kJ`mol-1,利用盖斯定律可计算1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式。
(1)选用熟石灰调节pH,原料来源丰富,价格便宜,且引人离子对人体无害,注意pH过大或过小,都将直接发生Al与酸或碱的反应,否则会造成Al的大量消耗,
故答案为:来源丰富、价格便宜;引入的Ca2+对人体无害;铝;
(2)铝粉与硝酸根离子发生氧化还原反应生成固体,则固体为氢氧化铝,则硝酸被还原为氮气,则在溶液中铝粉和NO3-反应的离子方程式为10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-,
故答案为:10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-;
(3)H2催化还原饮用水中NO3-,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3-![]() N2+4H2O+2OH-(或5H2+2NO3-+2H+
N2+4H2O+2OH-(或5H2+2NO3-+2H+![]() N2↑+6H2O);
N2↑+6H2O);
(4)由图可知,第一步热化学反应为NH4+(aq)+![]() O2(g)=2H+(aq)+NO2-(aq)+H2O(l) △H=-2736 kJ·mol-1 ①,第二步热化学反应为NO2-(aq)+
O2(g)=2H+(aq)+NO2-(aq)+H2O(l) △H=-2736 kJ·mol-1 ①,第二步热化学反应为NO2-(aq)+![]() O2(g)=NO3-(aq) △H=-73kJ·mol-1 ②,
O2(g)=NO3-(aq) △H=-73kJ·mol-1 ②,
由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式为NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l) △H=-346 kJ·mol-1,
故答案为:NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l) △H=-346 kJ·mol-1。

 小题狂做系列答案
小题狂做系列答案【题目】羰基硫(COS)可用于合成除草剂、杀草丹等农药。可通过H2S与CO2在高温下反应制得COS:H2S(g)+CO2(g) ![]() COS(g) +H2O(g) △H > 0。在2 L容器中充入一定量的H2S和CO2发生上述反应,数据如下:
COS(g) +H2O(g) △H > 0。在2 L容器中充入一定量的H2S和CO2发生上述反应,数据如下:
实验 | 温度/℃ | 起始时 | 平衡时 | 平衡 常数 | |||
n(CO2)/mol | n(H2S)/mol | n(COS)/mol | n(H2O)/mol | n(COS)/mol | |||
1 | T1 | 0.200 | 0.200 | 0 | 0 | 0.0200 | K1 |
2 | T2 | 0.200 | 0.200 | 0 | 0 | n2 | K2 =1/36 |
3 | T2 | 0.400 | 0.400 | 0 | 0 | n3 | K3 |
下列判断不正确的是
A. K1=1/81
B. K2 = K3且n3= 2n2
C. 初始反应速率:实验3 gt; 实验2 > 实验1
D. 实验2中平衡时的c(COS)约为0.0286 mol·L-1
【题目】硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
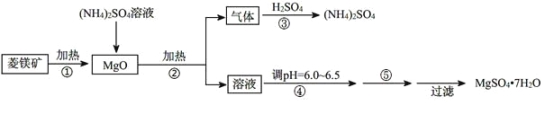
(1)步骤②中发生反应的离子方程式为____________________________________。
(2)步骤④中调节pH=6.0~6.5的目的是___________________________________。
(3)步骤⑤的操作为______________________________
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为_____[25℃时,Ksp[Mg(OH)2] =5.6×10-12]。