��Ŀ����
����Ŀ����Ԫ������Ȼ������Ҫ��������������Ҫ�ɷ�ΪAl2O3��������Fe2O3��FeO��SiO2���С���ҵ�����������Ʊ�����ij�ֻ�����Ĺ����������¡�
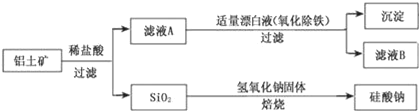
��1������ҺA�м���Ư��Һ��Ŀ��������������������ҺB�����ԡ�
�ٸù������漰ij������ԭ��Ӧ���£�����ɣ�__Fe2+___ClO��+�� ��___=____Fe��OH��3��+__C1��+�� ����
�ڼ�����ҺB���Ƿ�����Ԫ�صķ���Ϊ��________��ע���Լ�������
�۽���ҺB�е���Ԫ���Գ�����ʽ��������ѡ�õ�����Լ�Ϊ___������ţ���
a������������Һ b��������Һ c����ˮ d��������̼
������ҺB�Ʊ��Ȼ��������漰�IJ���Ϊ���ߵμ�Ũ���������Ũ������ȴ�ᾧ��____����������ƣ���ϴ�ӡ�
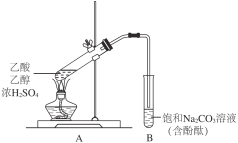
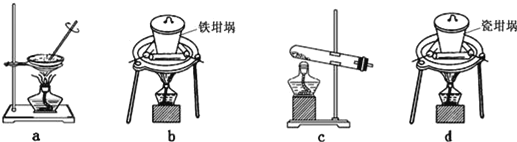
��2��SiO2��NaOH�����Ʊ������ƣ��ɲ��õ�װ��Ϊ___������ţ���
���𰸡�2��1��5��H2O��1��4��H+ ȡ������ҺB������KSCN��Һ��������죬�ټ�����ˮ����Ȼ����죬˵����ҺB�в�����Ԫ�� c ���� b
��������
��1���������̷�������Һ�к����Ȼ������Ȼ��������Ȼ���������ҺA�м���Ư��Һ��Ŀ��������������������ҺB�����ԣ�����������Ӿ���������������������Ϊ����������Һ���γ���������������ȥ������������ԭ��Ӧ�����غ��ԭ���غ���ƽ�����ݳ������ӵļ��鷽���������
��2������ʵ��Ŀ�ļ��������ʷ���ѡ��ʵ��������
��1������Һ�к����Ȼ������Ȼ��������Ȼ���������ҺA�м���Ư��Һ��Ŀ��������������������ҺB�����ԣ�����������Ӿ���������������������Ϊ����������Һ���γ���������������ȥ���������ӱ�����Ϊ����������Һ���γ�������������������������ӱ���ԭΪ�����ӣ���Ӧ�����ӷ���ʽΪ��2Fe2++ClO-+5H2O=2Fe��OH��3��+C1-+4H+���ʴ�Ϊ��2��1��5��H2O��1��4��H+��
����ҺB���Ƿ�����Ԫ�صķ���Ϊ���������ӵļ��鷽�����м��飬ȡ������ҺB������KSCN��Һ��������죬�ټ�����ˮ����Ȼ����죬˵����ҺB�в�����Ԫ�أ��ʴ�Ϊ��ȡ������ҺB������KSCN��Һ��������죬�ټ�����ˮ����Ȼ����죬˵����ҺB�в�����Ԫ�أ�
����Һ�к��е����Ȼ�����Һ������ҺB�е���Ԫ���Գ�����ʽ������
a������������Һ���Գ��������ӵ��������ܽ�������������a������ã�
b��������Һ���ܳ��������ӣ���b�����ϣ�
c����ˮ��������ܽ����������������İ�ˮ���������γ����������������˵õ������������壬��c���ϣ�
d��������̼���Ȼ�������Ӧ������������������������d�����ϣ��ʴ�Ϊ��c��
�ܼ���Ũ���������Ȼ�����ˮ�⣬����Ũ����ȴ�ᾧ�����ˣ�ϴ�ӣ��ʴ�Ϊ�����ˣ�
��2��a�������������ڹ��壬��a�����ϣ�
b���������������ڶ���������������ƣ���b���ϣ�
c�������к�����������������Ʒ�Ӧ����c�����ϣ�
d�����������ж���������������Ʒ�Ӧ����d�����ϣ��ʴ�Ϊ��b��