题目内容
12.2015年8月12日晚天津开发区化工厂发生爆炸事故.化工厂里面有各种危险化学品,其中有一种叫电石的固体,其主要成分为碳化钙(CaC2),可与水反应生成可燃性气体乙炔(C2H2),十分危险,同时生成一种白色固体.提出问题:白色固体是什么物质?
作出猜想:猜想一:CaO; 猜想二:CaCO3; 猜想三:Ca(OH)2.
交流与反思:经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是CaO+H2O=Ca(OH)2(用化学方程式回答).
进行实验:(一)取少量白色固体放入试管中,滴入稀盐酸,没有观察到有气泡产生,证明猜想二不成立.
(二)取少量白色固体加入水中,取上层清液,加入少量碳酸钠溶液,有白色沉淀出现,证明猜想三成立.碳化钙与水反应的方程式为CaC2+2H2O=Ca(OH)2+C2H2↑.
分析 【做出猜想】
根据质量守恒定律的元素守恒可知,白色固体可能是氧化钙,或碳酸钙,或氢氧化钙;
【交流反思】
氧化钙能和水反应生成氢氧化钙;
【进行实验】
考虑:二氧化碳能使澄清的石灰水变浑浊,碳化钙与水反应生成氢氧化钙和乙炔.
解答 解:【做出猜想】根据质量守恒定律的元素守恒,化学变化过程中元素种类不变,反应前有钙、碳、氢、氧元素,故生成的白色固体可能是CaO或CaCO3或Ca(OH)2,故答案为:CaCO3;
【交流反思】因为CaO能与水反应生成氢氧化钙,故猜想一不成立,化学方程式:CaO+H2O=Ca(OH)2,
故答案为:CaO+H2O=Ca(OH)2;
【进行实验】
(一)根据碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳;如果取少量白色固体放入试管中,滴加稀盐酸,没有观察到气泡放出,则证明猜想二不成立,故答案为:有气泡产生;
(二)根据碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠.使澄清的石灰水变浑浊;则取少量白色固体加入到水中,取上层清液,加入少量碳酸钠溶液,有白色沉淀出现,证明猜想三成立.碳化钙与水反应的方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑.
故答案为:少量碳酸钠溶液;CaC2+2H2O=Ca(OH)2+C2H2↑.
点评 本题考查探究物质的组成或测量物质的含量,为高频考点,侧重分析、推断能力的综合考查,题目难度中等.

练习册系列答案
相关题目
2.如表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N,⑥Si,⑦S.
(2)画出原子的结构示意图:④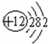 ,⑧
,⑧ ;
;
(3)在表中有编号的元素中,金属性最强的元素是K,非金属性最强的元素是F,用电子式表示它们形成化合物的过程 .最不活泼的元素是Ar.(以上均填元素名称)
.最不活泼的元素是Ar.(以上均填元素名称)
(4)元素③、⑩、的氢氧化物碱性由强到弱的顺序KOH>NaOH;元素⑥、⑦、⑧的氢化物稳定性由弱到强的顺序SiH4<H2S<HCl(均用化学式填空)
(5)周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O;.
(6)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,它与⑦的最高价氧化物的水化物浓溶液在加热时能反应,写出化学反应方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(7)写出能验证⑦的非金属性强于A的化学反应的离子方程式:CO32-+2H+=CO2↑+H2O.
 | ⅠA | ⅡA | ⅢA | ⅠVA | VA | VⅠA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
(2)画出原子的结构示意图:④
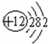 ,⑧
,⑧ ;
;(3)在表中有编号的元素中,金属性最强的元素是K,非金属性最强的元素是F,用电子式表示它们形成化合物的过程
 .最不活泼的元素是Ar.(以上均填元素名称)
.最不活泼的元素是Ar.(以上均填元素名称)(4)元素③、⑩、的氢氧化物碱性由强到弱的顺序KOH>NaOH;元素⑥、⑦、⑧的氢化物稳定性由弱到强的顺序SiH4<H2S<HCl(均用化学式填空)
(5)周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O;.
(6)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,它与⑦的最高价氧化物的水化物浓溶液在加热时能反应,写出化学反应方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(7)写出能验证⑦的非金属性强于A的化学反应的离子方程式:CO32-+2H+=CO2↑+H2O.
3.某有机物其结构简式为 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 不能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能和3mol H2反应 | |
| D. | 一定条件下,不能和NaOH醇溶液反应 |
7.已知Na2SO4 和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的0.8倍,下列叙述中正确的是( )
| A. | Na2SO4和NaCl的物质的量之比为1:8 | |
| B. | 溶液中一定有0.1molNa2SO4和0.8molNaCl | |
| C. | SO42-所带电荷数是Na+的0.8倍 | |
| D. | SO42- 与Cl-的物质的量之和等于Na+的物质的量 |
17.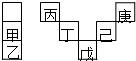 甲~庚元素在周期表中的相对位置如图,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚元素在周期表中的相对位置如图,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
 甲~庚元素在周期表中的相对位置如图,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚元素在周期表中的相对位置如图,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | 丙与戊的原子序数相差27 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 丁的最高价氧化物可用于制造光导纤维 | |
| D. | 常温下,甲和乙的单质均能与水剧烈反应 |
1.设 NA为阿伏加德罗常数,下列说法中正确的是( )
| A. | 在常温常压下,22.4 L 氧气所含的分子数目为NA | |
| B. | 44 g 二氧化碳所含的原子数目为NA | |
| C. | 18 g 水所含的电子数目为9 NA | |
| D. | 1 mol 钠作为还原剂所提供的电子数为NA |
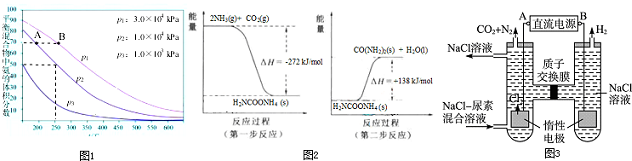
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.