题目内容
7.已知Na2SO4 和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的0.8倍,下列叙述中正确的是( )| A. | Na2SO4和NaCl的物质的量之比为1:8 | |
| B. | 溶液中一定有0.1molNa2SO4和0.8molNaCl | |
| C. | SO42-所带电荷数是Na+的0.8倍 | |
| D. | SO42- 与Cl-的物质的量之和等于Na+的物质的量 |
分析 NaCl溶液中c(Na+)=c(Cl-),Na2SO4 和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的0.8倍,则多余钠离子为硫酸钠电离得到的,且Na2SO4和NaCl电离得到的钠离子浓度之比为0.2:0.8=1:4,每个硫酸钠化学式中含有两个钠离子,所以硫酸钠和氯化钠的物质的量之比=0.5:4=1:8,
A.根据分析确定Na2SO4和NaCl的物质的量之比;
B.根据n=CV计算;
C.根据钠原子、S原子守恒判断;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:NaCl溶液中c(Na+)=c(Cl-),Na2SO4 和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的0.8倍,则多余钠离子为硫酸钠电离得到的,且Na2SO4 和NaCl电离得到的钠离子浓度之比为0.2:0.8=1:4,每个硫酸钠化学式中含有两个钠离子,所以硫酸钠和氯化钠的物质的量之比=0.5:4=1:8,
A.根据分析确定Na2SO4和NaCl的物质的量之比为1:8,故A正确;
B.溶液体积未知、物质的量浓度未知,所以无法计算其物质的量,故B错误;
C.根据分析结合钠原子、S原子守恒得SO42-、Na+的物质的量之比为1:10,其电荷之比为1:5,故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得2n(SO42- )+n(Cl-)=n(Na+),所以SO42- 与Cl-的物质的量之和不等于Na+,故D错误;
故选A.
点评 本题考查物质的量有关计算,为高频考点,根据物质的量公式、物质构成结合原子守恒、电荷守恒分析计算,易错选项是D.

练习册系列答案
相关题目
19.2mol•L-1的盐酸和硫酸各100mL,分别加入等质量的铁粉,反应后生成的气体质量比为2:3,则往盐酸中加入铁粉的物质的量为( )
| A. | 0.05mol | B. | 0.075mol | C. | 0.15mol | D. | 0.2mol |
18.下列电子式书写正确的是( )
| A. | HCl  | B. | HClO  | C. | H2O2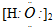 | D. | Na2O2 |
2.下列各组物质,按化合物、单质、混合物的顺序排列的是( )
| A. | 烧碱、液态氧、冰水混合物 | B. | 生石灰、白磷、小苏打 | ||
| C. | 干冰、铁、氨水 | D. | 空气、氮气、胆矾 |
19.NH3是重要的化工原料.
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为ACG或ADG.

(2)某学生用如图装置对NH3与NaClO的反应进行实验探究:
资料:氨和次氯酸钠溶液反应能生成肼.肼常温下是无色液体,沸点:113℃,与水混溶,它的水溶液是一种二元弱碱.
①向水中持续通入NH3,未观察到白雾.推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝.该实验不能判断白雾中含有N2H4,理由是白雾中混有NH3,NH3也可以使湿润的红色石蕊试纸变蓝.
②进一步实验确认了A中生成了N2H4.写出A中反应的化学方程式(N2不参与反应)2NH3+NaClO═N2H4+NaCl+H2O;此反应中若有5.6L氨气(标准状况下)参加反应,则转移电子的数目为0.25NA.
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为ACG或ADG.

(2)某学生用如图装置对NH3与NaClO的反应进行实验探究:
| 操作 | 现象 |
 | 液面上方出现白雾 |
①向水中持续通入NH3,未观察到白雾.推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝.该实验不能判断白雾中含有N2H4,理由是白雾中混有NH3,NH3也可以使湿润的红色石蕊试纸变蓝.
②进一步实验确认了A中生成了N2H4.写出A中反应的化学方程式(N2不参与反应)2NH3+NaClO═N2H4+NaCl+H2O;此反应中若有5.6L氨气(标准状况下)参加反应,则转移电子的数目为0.25NA.

 的含氧官能团的名称为醚键和羧基、羟基
的含氧官能团的名称为醚键和羧基、羟基 .
.