题目内容
(7分)请根据表格回答问题:
(ⅰ)根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
(1)在周期表中,最可能处于同一族的是( )
A.F和H B.H和I C.E和H D.E和I
(2)它们的氯化物的化学式,最可能正确的是( )
A.ECl B.FCl3 C.HCl D.ICl4
(3)F元素最可能是( )
A.S区元素 B.稀有气体元素 C.p区元素 D.准金属 E.d区元素
(ⅱ)右表是元素周期表的一部分:
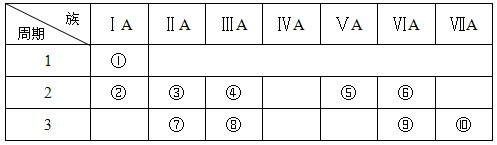
(4)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是
其原子的结构示意图是 。
(5)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。这种现象被称为 。
(6)又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)。
(ⅰ)根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
| 元素代号 | I1 | I2 | I3 | I4 |
| E | 500 | 4600 | 6900 | 9500 |
| F | 740 | 1500 | 7700 | 10500 |
| H | 580 | 1800 | 2700 | 11600 |
| I | 420 | 3100 | 4400 | 5900 |
A.F和H B.H和I C.E和H D.E和I
(2)它们的氯化物的化学式,最可能正确的是( )
A.ECl B.FCl3 C.HCl D.ICl4
(3)F元素最可能是( )
A.S区元素 B.稀有气体元素 C.p区元素 D.准金属 E.d区元素
(ⅱ)右表是元素周期表的一部分:

(4)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是
其原子的结构示意图是 。
(5)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。这种现象被称为 。
(6)又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)。
(1)D (2)A (3)A (4) N 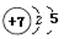 (5) 对角线规则 (6)Li
(5) 对角线规则 (6)Li
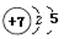 (5) 对角线规则 (6)Li
(5) 对角线规则 (6)Li(1)根据表中电离能的数据可知,E和I的第二电离能远大于低于电离能,所以均是第IA元素;而F应该是第ⅡA元素,H应该是ⅢA元素,所以答案选D。
(2)根据元素所在的族序数可知,E、F、H、I分别应该是ECl、FCl2、HCl3、ICl,所以答案选A。
(3)由于F是第ⅡA元素,所以F是S区元素,答案选A。
(4)根据构造原理可知,如果元素原子的核外p电子数比s电子数少1,则该元素一定是氮元素,其原子结构示意图是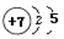 。
。
(5)根据元素在周期表中的位置可知,③和⑧处于对角线位置,所以这种现象被称为对角线规则。
(6)⑦是镁元素和Li元素处于对角线位置,二者的性质是相似的。
(2)根据元素所在的族序数可知,E、F、H、I分别应该是ECl、FCl2、HCl3、ICl,所以答案选A。
(3)由于F是第ⅡA元素,所以F是S区元素,答案选A。
(4)根据构造原理可知,如果元素原子的核外p电子数比s电子数少1,则该元素一定是氮元素,其原子结构示意图是
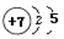 。
。(5)根据元素在周期表中的位置可知,③和⑧处于对角线位置,所以这种现象被称为对角线规则。
(6)⑦是镁元素和Li元素处于对角线位置,二者的性质是相似的。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
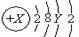 。则X、Y及该原子3p能级上的电子数分别为( )
。则X、Y及该原子3p能级上的电子数分别为( )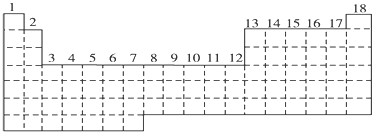
 子层,第一层与最外层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子
子层,第一层与最外层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子 数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答: 质有 、
质有 、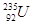 是重要的工业原料,铀浓缩一直为国际社会关注。下列有关
是重要的工业原料,铀浓缩一直为国际社会关注。下列有关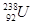 互为同位素
互为同位素