题目内容
【题目】一定温度下,在固定容积、体积为2L的密闭容器中充入1molN2和3molH2发生反应,当反应进行到10s末时达到平衡,此时容器中c(NH3)=0.15mol·L-1。下列有关判断不正确的是
A.反应达平衡时N2的转化率为7.5%
B.反应进行到10s末时,H2的平均反应速率是0.0225mol·(L·s)-1
C.该反应达到平衡时的标志是容器中气体密度不再改变
D.再往该容器中充入1molN2和3molH2,重新达到平衡时c(NH3)=0.30mol/L
【答案】B
【解析】
试题分析:发生反应:N2(g)+3H2(g) ![]() 2NH3(g)。A.平衡时容器中c(NH3)=0.15mol/L,则氮气的浓度变化量=0.15mol/L×
2NH3(g)。A.平衡时容器中c(NH3)=0.15mol/L,则氮气的浓度变化量=0.15mol/L×![]() =0.075mol/L,故氮气的转化率=
=0.075mol/L,故氮气的转化率=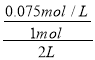 ×100%=15%,故A错误;B.10s末时达到平衡时容器中c(NH3)=0.15mol/L,故v(NH3)=
×100%=15%,故A错误;B.10s末时达到平衡时容器中c(NH3)=0.15mol/L,故v(NH3)=![]() =0.015mol/(L.s),v(H2)=
=0.015mol/(L.s),v(H2)=![]() v(NH3)=0.0225mol/(L.s),故B正确;C.容器内反应混合气体的密度始终不变,故容器中气体密度不改变不能说明平衡到达平衡,故C错误;D.再往该容器中充入1mol N2和3mol H2,等效为在原平衡基础上体积缩小一倍,若平衡不移动,平衡时氨气的浓度为0.3mol/L,体积缩小一倍,则压强增大一倍,平衡向正反应方向移动,故平衡时氨气的浓度大于0.3mol/L,故D错误;故选B。
v(NH3)=0.0225mol/(L.s),故B正确;C.容器内反应混合气体的密度始终不变,故容器中气体密度不改变不能说明平衡到达平衡,故C错误;D.再往该容器中充入1mol N2和3mol H2,等效为在原平衡基础上体积缩小一倍,若平衡不移动,平衡时氨气的浓度为0.3mol/L,体积缩小一倍,则压强增大一倍,平衡向正反应方向移动,故平衡时氨气的浓度大于0.3mol/L,故D错误;故选B。

练习册系列答案
相关题目
