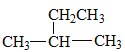题目内容
【题目】A、B、C、D是四种短周期元素,E是过渡金属元素。A、B、C同周期,C、D同主族,A的原子结构示意图为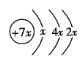 ,B的核外电子排布式为
,B的核外电子排布式为![]() ,C的最外层有三个单电子,E的价电子排布式为
,C的最外层有三个单电子,E的价电子排布式为![]() 。试回答下列问题:
。试回答下列问题:
(1)写出下列元素的符号:A______,B______,C______,D______。
(2)E元素原子的核电荷数是______,E元素在周期表中位于第______周期第______族;已知元素周期表可按电子排布分为![]() 区、
区、![]() 区、
区、![]() 区等,则E元素在______区。
区等,则E元素在______区。
(3)画出D的核外电子排布图:______。
【答案】![]()
![]()
![]()
![]() 26 四 Ⅷ
26 四 Ⅷ ![]()
![]()
【解析】
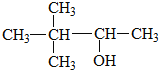
A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素。
(1)由上述分析可知,A为Si、B为Na、C为P、D为N;
(2) E为Fe元素,E的核外电子排布式为1s22s22p63s23p63d64s2,故核电荷数是26,Fe在周期表中处于第四周期第Ⅷ族,在周期表中处于d区;
(3) N是7号元素,核外电子排布图为![]() 。
。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】下表为元素周期表的短周期部分
a | |||||||
b | c | d | |||||
e | f | g | h |
请参照元素a﹣h在表中的位置,根据判断出的元素回答问题:
(1)h原子核外有______ 种不同伸展方向的电子云,最外层共有______ 种不同运动状态的电子。
(2)比较d、e元素常见离子的半径大小(用化学式表示)______>______;b、c 两元素非金属性较强的是(写元素符号)______,写出证明这一结论的一个化学方程式______。
(3)d、e元素形成的四原子化合物的电子式为______;b、g元素形成的分子bg2为______分子(填写“极性”或“非极性”)。
(4)上述元素可组成盐R:ca4f(gd4)2,和盐S:ca4agd4,相同条件下,0.1mol/L 盐R中c(ca4+)______(填“等于”、“大于”或“小于”)0.1mol/L 盐S中c(ca4+)
(5)向盛有10mL1mol/L盐S溶液的烧杯中滴加1mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是______。
(6)向盛有10mL 1mol/L盐 R溶液的烧杯中滴加1mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL﹣35mL)间发生的离子方程式:______。若在10mL 1mol/L 盐R溶液的烧杯中加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______mol。