题目内容
 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
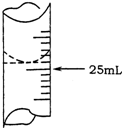
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如右图,则此时消耗标准溶液的体积为
23.70mL
23.70mL
;(2)乙学生做了三组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol?L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
0.1092mol?L-1
0.1092mol?L-1
(小数点后保留四位);(3)下列哪些操作会使测定结果偏高
AC
AC
(填序号).A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(4)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ?mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-207.0KJ/mol;
CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-207.0KJ/mol;
.分析:(1)根据滴定管的精确度为0.01mL;
(2)根据c(待测)=
计算,V(标准)用三次的平均值;
(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多;根据c(待测)=
分析误差;
(4)依据热化学方程式和盖斯定律计算得到;
(2)根据c(待测)=
| c(标准液)×V(标准液) |
| V(待测液) |
(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多;根据c(待测)=
| c(标准液)×V(标准液) |
| V(待测液) |
(4)依据热化学方程式和盖斯定律计算得到;
解答:解:(1)记录滴定前滴定管内液面读数为1.10mL,滴定后液面如右图为24.80ml,滴定管中的液面读数为24.80ml-1.100ml=23.70mL,
故答案为:23.70mL;
(2)标准液消耗的体积V(标准液)=
=27.31ml;根据c(待测)=
=
=0.1092mol?L-1;
故答案为:0.1092mol?L-1;
(3)A.锥形瓶用蒸馏水洗净后再用待测液润洗,待测液增多,消耗标准液增多,结果偏高,故A符合;
B.酸式滴定管用蒸馏水洗净后再用标准液润洗,符合实验操作,结果符合,故B不符合;
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,读出的标准液体积增大,结果偏高,故C符合;
D.滴定前读数正确,滴定后俯视滴定管读数,读数减小,标准液体积减小,结果偏低,故D不符合;
故答案为:AC;
(4)①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ?mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
依据盖斯定律①×3-③×2+②得到:6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=-1242.2KJ/mol;
得到热化学方程式为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-207.0KJ/mol;
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-207.0KJ/mol;
故答案为:23.70mL;
(2)标准液消耗的体积V(标准液)=
| 26.11+31.30-1.56+26.31-0.22 |
| 3 |
| c(标准液)×V(标准液) |
| V(待测液) |
| 0.1000mol/L×0.0273L |
| 0.0250L |
故答案为:0.1092mol?L-1;
(3)A.锥形瓶用蒸馏水洗净后再用待测液润洗,待测液增多,消耗标准液增多,结果偏高,故A符合;
B.酸式滴定管用蒸馏水洗净后再用标准液润洗,符合实验操作,结果符合,故B不符合;
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,读出的标准液体积增大,结果偏高,故C符合;
D.滴定前读数正确,滴定后俯视滴定管读数,读数减小,标准液体积减小,结果偏低,故D不符合;
故答案为:AC;
(4)①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ?mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
依据盖斯定律①×3-③×2+②得到:6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=-1242.2KJ/mol;
得到热化学方程式为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-207.0KJ/mol;
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-207.0KJ/mol;
点评:本题考查了酸碱中和滴定操作、误差分析以及注意事项,热化学方程式的应用,盖斯定律的计算应用,难度不大,应注意相关知识的积累.

练习册系列答案
相关题目
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: