题目内容
将V mL NO和NO2的混合气体通过足量水吸收后,得到a mL无色气体A,将A气体与等体积O2混合,再通过水充分吸收后,收集到5 mL无色气体B。试通过计算回答:
(1)A、B各为何种气体?
(2)A气体的体积是多少?
(3)V的取值范围是多少?
(1)A、B各为何种气体?
(2)A气体的体积是多少?
(3)V的取值范围是多少?
(1)A、B分别为NO、O2 (2)20 mL (3)(5,15)
因为3NO2+H2O====2HNO3+NO
所以a mL无色气体为NO
将NO气体与氧气等体积混合,通过水发生的反应为:4NO+3O2+2H2O====4HNO3,由于氧气过量,所以收集到的5 mL无色气体B是氧气
4NO + 3O2+2H2O====4HNO3
4 mL 3 mL
V(NO) V(NO)-5 mL
V(NO)="20" mL
若V mL气体全部是NO时,V=5,由于是两种气体的混合气体,故V的取值大于5。
若VmL气体全部是NO2时
3NO2+H2O====2HNO3+NO
3 mL 1 mL
VmL 5 mL
V=15
由于是两种气体的混合气体,故V的取值小于15。
所以a mL无色气体为NO
将NO气体与氧气等体积混合,通过水发生的反应为:4NO+3O2+2H2O====4HNO3,由于氧气过量,所以收集到的5 mL无色气体B是氧气
4NO + 3O2+2H2O====4HNO3
4 mL 3 mL
V(NO) V(NO)-5 mL
V(NO)="20" mL
若V mL气体全部是NO时,V=5,由于是两种气体的混合气体,故V的取值大于5。
若VmL气体全部是NO2时
3NO2+H2O====2HNO3+NO
3 mL 1 mL
VmL 5 mL
V=15
由于是两种气体的混合气体,故V的取值小于15。

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
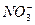 、Cl-
、Cl-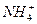 、K+、OH-、
、K+、OH-、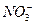 的物质的量为( )
的物质的量为( )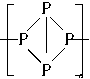 ,有关它的下列叙述不正确的是( )?
,有关它的下列叙述不正确的是( )?