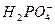题目内容
(6分) “神舟”7号宇宙飞船是靠长征Ⅱ(F)型运载火箭发射升空的。该火箭所用的燃料是偏二甲肼〔(CH3)2N—NH2〕,氧化剂是N2O4,产物是氮气、二氧化碳和水。
(1)火箭点火瞬间,逸出的红棕色气体是_______,产生该气体的化学反应方程式为
_________。
(2)偏二甲肼在N2O4中燃烧的化学方程式为_________________________,当有1 mol偏二甲肼燃烧时,转移电子的物质的量为___________。
(1)火箭点火瞬间,逸出的红棕色气体是_______,产生该气体的化学反应方程式为
_________。
(2)偏二甲肼在N2O4中燃烧的化学方程式为_________________________,当有1 mol偏二甲肼燃烧时,转移电子的物质的量为___________。
(1)NO2 N2O4 2NO2
2NO2
(2)(CH3)2N—NH2+2N2O4 3N2+2CO2+4H2O 16 mol
3N2+2CO2+4H2O 16 mol
 2NO2
2NO2(2)(CH3)2N—NH2+2N2O4
 3N2+2CO2+4H2O 16 mol
3N2+2CO2+4H2O 16 mol本题以新信息为切入点考查了氧化还原的知识。由于所用氧化剂是N2O4,在N2O4中存在N2O4 2NO2平衡,所以逸出的红棕色气体是NO2。由题意可知(CH3)2N—NH2和N2O4是反应物,产物是氮气、二氧化碳和水。所以方程式:(CH3)2N—NH2+2N2O4
2NO2平衡,所以逸出的红棕色气体是NO2。由题意可知(CH3)2N—NH2和N2O4是反应物,产物是氮气、二氧化碳和水。所以方程式:(CH3)2N—NH2+2N2O4 3N2+2CO2 +4H2O,由题意可知,N2O4→N2,化合价降低4,所以当有1 mol偏二甲肼燃烧时,转移电子的物质的量为2×2×4 mol="16" mol。
3N2+2CO2 +4H2O,由题意可知,N2O4→N2,化合价降低4,所以当有1 mol偏二甲肼燃烧时,转移电子的物质的量为2×2×4 mol="16" mol。
 2NO2平衡,所以逸出的红棕色气体是NO2。由题意可知(CH3)2N—NH2和N2O4是反应物,产物是氮气、二氧化碳和水。所以方程式:(CH3)2N—NH2+2N2O4
2NO2平衡,所以逸出的红棕色气体是NO2。由题意可知(CH3)2N—NH2和N2O4是反应物,产物是氮气、二氧化碳和水。所以方程式:(CH3)2N—NH2+2N2O4 3N2+2CO2 +4H2O,由题意可知,N2O4→N2,化合价降低4,所以当有1 mol偏二甲肼燃烧时,转移电子的物质的量为2×2×4 mol="16" mol。
3N2+2CO2 +4H2O,由题意可知,N2O4→N2,化合价降低4,所以当有1 mol偏二甲肼燃烧时,转移电子的物质的量为2×2×4 mol="16" mol。
练习册系列答案
相关题目
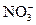 ="===3" Cu2++2NO↑+4H2O
="===3" Cu2++2NO↑+4H2O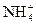 +H2O
+H2O