题目内容
【题目】工业上可用粗硅(含铁、铝、硼、磷等杂质)与干燥的HCl气体反应制得SiHCl3:Si+3HCl=SiHCl3+H2,SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅。
有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | SiHCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | — | 315 | 33.0 | — |
熔点/℃ | -70.0 | -107.2 | — | — | -126.5 | — |
升华温度/℃ | — | — | 180 | 300 | 162 |
(1)粗硅与HCl反应完全后,经冷凝得到的SiHCl3中含有少量SiCl4,提纯SiHCl3可采用
___________的方法
(2)实验室也可用SiHCl3与过量干燥的H2反应制取纯硅,装置如下图所示(加热和夹持装置略去):

①装置B中的试剂是___________,装置C需水浴加热,目的是 ____________________。
②反应一段时间后,装置D中可观察到有晶体硅生成,装置D不能采用普通玻璃管的原因是_____________。
【答案】 蒸馏 浓硫酸 使SiHCl3气化,与氢气反应 SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,温度太高,普通玻璃管易熔化
【解析】(1)根据题示的数据可知,可以利用沸点的不同提纯SiHCl3,操作为蒸馏,故答案为:蒸馏;
(2)①生成的氢气中含有水蒸气,进入装置D之前需要干燥,装置B中的试剂可以干燥氢气,浓硫酸是常用的干燥剂,因此装置B中的试剂是浓硫酸,装置C需水浴加热,目的是使SiHCl3汽化,在D中与氢气反应,故答案为:浓硫酸;使SiHCl3气化,与氢气反应;
②SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,温度太高,普通玻璃管易熔化,故答案为:SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,温度太高,普通玻璃管易熔化。

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】对甲基苯胺可用对硝基甲苯在酸性条件下用铁粉还原制得:

主要反应物和产物的物理性质见下表:
化合物 | 物质状态 | 溶解性 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
对硝基甲苯 | 浅黄色晶体 | 不溶于水,溶于乙醇、苯 | 51.4 | 237.7 | 1.286 |
对甲基苯胺 | 白色片状晶体 | 微溶于水,易溶于乙醇、苯 | 43~45 | 200~202 | 1.046 |
对甲基苯胺盐酸盐 | 白色晶体 | 易溶于水,不溶于乙醇、苯 | 243~245 | —— | —— |
苯 | 无色液体 | 不溶于水,溶于乙醇 | 5.5 | 80.1 | 0.874 |
实验流程如下:

请回答下列问题:
(1)反应装置如图,a处缺少一装置_____________(填仪器名称)
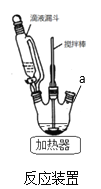
(2)步骤②中加苯的作用是_____________,步骤②中用5%碳酸钠溶液调pH=7~8的原因_________
(3)步骤③得到的固体物质为_________
(4)步骤④中加入盐酸的作用是_____________
(5)步骤⑤中通过加入氢氧化钠溶液使对甲基苯胺结晶析出的原理为_____________
(6
A. 蒸馏水 B.乙醇 C.NaOH溶液 D.HCl溶液
【题目】在某温度T℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下[2NO2(g)![]() N2O4(g) △H<0]:
N2O4(g) △H<0]:
容器 | 物质 | 起始浓度/(mol | 平衡浓度/(mol |
Ⅰ | N2O4 | 0.100 | 0.040 |
NO2 | 0 | 0.120 | |
Ⅱ | N2O4 | 0 | 0.0142 |
NO2 | 0.100 | 0.0716 |
下列说法不正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应的转化率a(N2O4)>a(NO2)
B. 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ)
C. 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(I)=![]()
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
