题目内容
【题目】将由等物质量的铝、镁组成的混合物分成四等份,分别加入足量的①3mol/LNaOH溶液,②2mol/L稀硝酸(还原产物仅有NO),③18mol/LH2SO4,④1mol/LH2SO4产生气体物质的量由小到大的顺序为( )
A.①②③④B.②③①④C.④②①③D.③①②④
【答案】D
【解析】
设每一份中金属的物质的量都是1mol,则:
①根据反应2Al+2H2O+2NaOH=2NaAlO2+3H2↑,生成1.5mol氢气;
②根据反应Al+4HNO3=Al(NO3)3+2H2O+NO↑、3Mg+8HNO3=3Mg(NO3)2+4H2O+2NO↑,生成NO为1mol+![]() mol=
mol=![]() mol;
mol;
③根据反应Mg+2H2SO4=MgSO4+2H2O+ SO2↑,生成1molSO2(铝被钝化,不产生气体);
④根据反应Mg+H2SO4=MgSO4+H2↑、2Al+3H2SO4=Al2(SO4)3+3H2↑,中生成2.5mol氢气;
所以产生气体物质的量由小到大的顺序为③①②④;
答案选D。

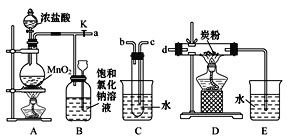
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验仪器,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。

(1)A 是制取 CO2 的装置,可选用的试剂_____(填序号)
①碳酸钙固体与稀硫酸 ②碳酸钠固体与稀盐酸 ③碳酸氢钠固体与氢氧化钠溶液
写出对应的离子方程式_________________。
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和 NaHCO3 溶液 | ____________ |
C | ____________ | 与 CO2 和水反应产生 O2 |
D | NaOH 溶液 | ____________ |
(3)写出过氧化钠与二氧化碳反应的化学方程式_____。
(4)用_____检验 F 中收集到的气体,现象是_____。
【题目】表是25℃时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | 1.8×10-10 | 2.0×10-12 | 1.8×10-5 | 3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水的离子方程式H2O+CO32-+Cl2=HCO3-+Cl-+HClO
C.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COO-):c(CH3COOH)=9:5,此时溶液pH=5
D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3,CrO42-先沉淀