��Ŀ����
���ڹ�����ռ����Ҫ�ĵ�λ��2008�꣬�ҹ��������ӽ�5 000��֡���ͼ�Ǻϳɰ��ļ�Ҫ���̡�

(1)�±��ǿ����в�������ķе㡣������Һ������ȷ��������±������жϣ����������õ���������_____________��

(2)��Ȼ�������͡�ú��������ˮ��Ӧ�Ƶ��������±���ij�ϳɰ������ò�ͬԭ�ϵ����Ͷ�ʺ��������ġ�

�������ϱ���Ϣ������Ϊ����____________Ϊԭ����á�
����д�������ڸ��¡���������������ˮ������Ӧ����������һ����̼�Ļ�ѧ����ʽ��__________��
����֪C(s)��CO(g)��H2 (g)��ȫȼ�յ��Ȼ�ѧ����ʽ�ֱ�Ϊ��
C(s)+O2(g)=CO2 (g) ��H=-394 kJ.mol-1;
2CO(g)+O2(g)=2CO2(g) ��H=-566 kJ. mol-1;
2H2(g)+O2(g)=2H2O(g) ��H=-484 kJ.mol-1.
��д����C��ˮ�����ڸ��������·�Ӧ����������һ����̼���Ȼ�ѧ����ʽ��_________________
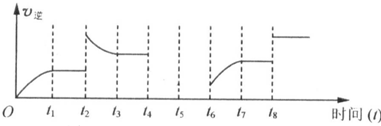
(3)�±�����ij�ִ����������������Ϊ1:3�ĵ�����������Ӧ�ﵽƽ��ʱ��һЩʵ�����ݡ�
����д�������ڸ��¡���������������ˮ������Ӧ����������һ����̼�Ļ�ѧ����ʽ��__________��
����֪C(s)��CO(g)��H2 (g)��ȫȼ�յ��Ȼ�ѧ����ʽ�ֱ�Ϊ��
C(s)+O2(g)=CO2 (g) ��H=-394 kJ.mol-1;
2CO(g)+O2(g)=2CO2(g) ��H=-566 kJ. mol-1;
2H2(g)+O2(g)=2H2O(g) ��H=-484 kJ.mol-1.
��д����C��ˮ�����ڸ��������·�Ӧ����������һ����̼���Ȼ�ѧ����ʽ��_________________
(3)�±�����ij�ִ����������������Ϊ1:3�ĵ�����������Ӧ�ﵽƽ��ʱ��һЩʵ�����ݡ�

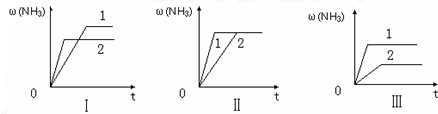
�����ݱ��������жϣ��ϳɰ���ӦN2+3H2 2NH3�� ��H____________0���>����<�������жϡ��������Ҫ˵������______________��
2NH3�� ��H____________0���>����<�������жϡ��������Ҫ˵������______________��
�ڸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ��_________________��
����300�桢10 MPa�£��ϳɰ���Ӧ�ﵽƽ��ʱ��������������Ƿ�Ӧ��ʼʱ��_____________����
 2NH3�� ��H____________0���>����<�������жϡ��������Ҫ˵������______________��
2NH3�� ��H____________0���>����<�������жϡ��������Ҫ˵������______________�� �ڸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ��_________________��
����300�桢10 MPa�£��ϳɰ���Ӧ�ﵽƽ��ʱ��������������Ƿ�Ӧ��ʼʱ��_____________����
(1)����
(2)����Ȼ�� ����CH4+ H2O CO+3H2 ����C(s)+H2O(g)
CO+3H2 ����C(s)+H2O(g) CO(g)+H2(g) ��H=131 kJ��mol-1
CO(g)+H2(g) ��H=131 kJ��mol-1
(3)��< ����ͬ�����£������¶ȣ�NH3������С��ƽ�����ƣ��淴Ӧ���ȣ�����Ӧ����
��
��0. 658��
(2)����Ȼ�� ����CH4+ H2O
 CO+3H2 ����C(s)+H2O(g)
CO+3H2 ����C(s)+H2O(g) CO(g)+H2(g) ��H=131 kJ��mol-1
CO(g)+H2(g) ��H=131 kJ��mol-1 (3)��< ����ͬ�����£������¶ȣ�NH3������С��ƽ�����ƣ��淴Ӧ���ȣ�����Ӧ����
��

��0. 658��


��ϰ��ϵ�д�
 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д� ȫ�ų��100��ϵ�д�
ȫ�ų��100��ϵ�д�
�����Ŀ

 2NH3�ġ�H
2NH3�ġ�H