题目内容
【化学--物质结构与性质】已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属.请回答下列问题:
(1)X、Y、Z第一电离能由小到大的顺序为 < < (填元素符号).
(2)E元素基态原子的电子排布式为 .
(3)XZ2分子中含有 个π键.
(4)Z氢化物的沸点比Q氢化物的沸点高,理由是 .
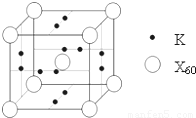
(5)X元素可形成X60单质,它与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),该化合物中X60与钾原子个数比为 .
【答案】分析:X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,则X原子核外电子数为6,故X为碳元素;Z原子L层上有2对成对电子,则Z原子核外电子排布为1s22s22p4,故Z为氧元素;Y原子序数介于碳元素与氧元素之间,故Y为氮元素;Q是第三周期中电负性最大的元素,Q为Cl元素;E的单质是常温下唯一呈液态的非金属,E为Br元素,
(1)同周期自左而右第一电离能呈增大趋势,但氮原子2p能级有3个电子,处于半满稳定状态,能量降低,失去电子需要能量较高;
(2)E为Br元素,原子核外电子数为35,根据核外电子排布规律书写;
(3)CO2分子中C原子成2个C=O双键,双键中含有1个σ键、1个π键;
(4)氧元素的电负性很强,水分子之间存在氢键,导致熔沸点升高;
(5)根据均摊法计算晶胞中X60与钾原子个数,据此计算.
解答:解:X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,则X原子核外电子数为6,故X为碳元素;Z原子L层上有2对成对电子,则Z原子核外电子排布为1s22s22p4,故Z为氧元素;Y原子序数介于碳元素与氧元素之间,故Y为氮元素;Q是第三周期中电负性最大的元素,Q为Cl元素;E的单质是常温下唯一呈液态的非金属,E为Br元素,
(1)同周期自左而右第一电离能呈增大趋势,但氮原子2p能级有3个电子,处于半满稳定状态,能量降低,失去电子需要能量较高,故N元素的第一电离能高于同周期相邻元素,故第一电离能C<O<N,故答案为:C;O;N;
(2)E为Br元素,原子核外电子数为35,核外电子排布式为1s22s22p63s23p63d104s24p5,故答案为:1s22s22p63s23p63d104s24p5;
(3)CO2分子中C原子成2个C=O双键,双键中含有1个σ键、1个π键,故CO2分子中含有2个π键,故答案为:2;
(4)氧元素的电负性很强,水分子之间存在氢键,导致熔沸点升高,故Z氢化物的沸点比Q氢化物的沸点高,
故答案为:氧元素的电负性很强,水分子之间存在氢键,导致熔沸点升高;
(5)由晶胞结构可知,晶胞中X60数目为1+8× =2,K原子数目为2×6×
=2,K原子数目为2×6× =6,故晶胞中X60与钾原子个数之比为2:6=1:3,故答案为:1:3.
=6,故晶胞中X60与钾原子个数之比为2:6=1:3,故答案为:1:3.
点评:本题考查核外电子排布规律、电离能、化学键与氢键、晶胞计算等,难度中等,注意利用均摊法进行晶胞的计算.
(1)同周期自左而右第一电离能呈增大趋势,但氮原子2p能级有3个电子,处于半满稳定状态,能量降低,失去电子需要能量较高;
(2)E为Br元素,原子核外电子数为35,根据核外电子排布规律书写;
(3)CO2分子中C原子成2个C=O双键,双键中含有1个σ键、1个π键;
(4)氧元素的电负性很强,水分子之间存在氢键,导致熔沸点升高;
(5)根据均摊法计算晶胞中X60与钾原子个数,据此计算.
解答:解:X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,则X原子核外电子数为6,故X为碳元素;Z原子L层上有2对成对电子,则Z原子核外电子排布为1s22s22p4,故Z为氧元素;Y原子序数介于碳元素与氧元素之间,故Y为氮元素;Q是第三周期中电负性最大的元素,Q为Cl元素;E的单质是常温下唯一呈液态的非金属,E为Br元素,
(1)同周期自左而右第一电离能呈增大趋势,但氮原子2p能级有3个电子,处于半满稳定状态,能量降低,失去电子需要能量较高,故N元素的第一电离能高于同周期相邻元素,故第一电离能C<O<N,故答案为:C;O;N;
(2)E为Br元素,原子核外电子数为35,核外电子排布式为1s22s22p63s23p63d104s24p5,故答案为:1s22s22p63s23p63d104s24p5;
(3)CO2分子中C原子成2个C=O双键,双键中含有1个σ键、1个π键,故CO2分子中含有2个π键,故答案为:2;
(4)氧元素的电负性很强,水分子之间存在氢键,导致熔沸点升高,故Z氢化物的沸点比Q氢化物的沸点高,
故答案为:氧元素的电负性很强,水分子之间存在氢键,导致熔沸点升高;
(5)由晶胞结构可知,晶胞中X60数目为1+8×
 =2,K原子数目为2×6×
=2,K原子数目为2×6× =6,故晶胞中X60与钾原子个数之比为2:6=1:3,故答案为:1:3.
=6,故晶胞中X60与钾原子个数之比为2:6=1:3,故答案为:1:3.点评:本题考查核外电子排布规律、电离能、化学键与氢键、晶胞计算等,难度中等,注意利用均摊法进行晶胞的计算.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目

 (2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是 碳原子的杂化轨道类型为
碳原子的杂化轨道类型为 (2010?济南二模)【化学-物质结构与性质】
(2010?济南二模)【化学-物质结构与性质】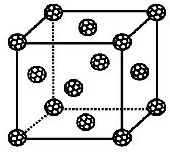 【化学-物质结构与性质】
【化学-物质结构与性质】