题目内容
【题目】含钴催化剂废料(含Fe3O4、Co2O3、Al2O3、CaO及SiO2为原料制取Co3O4的一种工艺流程如下:
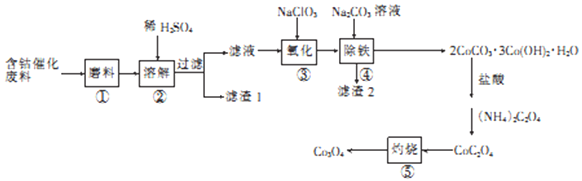
回答下列问题:
(1)CoC2O4中Co的化合价为_____。
(2)步骤②经溶解后过滤,滤渣1的主要成分为____(填化学式),滤液中含有_____种阳离子。
(3)步骤③氧化对Fe2+全部转化为Fe3+,反应的离子方程式为_______,检验其是否已完全氧化自方法是______________。
(4)步骤国加Na2CO3溶液的目的是_____________,滤渣2中含有Na2Fe6(S04)4(OH)x,则x=____,滤渣2中__________(填“含有”或“不含”Al(OH)3。
(5)某工厂用m1kg含钴催化剂废料Co2O3的质量分数为35%)制备Co3O4,最终得到产品m2kg,其产率为________(列出算式即可)。
【答案】 +2 SiO2 和CaSO4 6 6Fe2++6H++ClO3-=6Fe3++Cl-+3H2O 取少量上层清液,向其中滴加K3[Fe(CN)6]溶液,观察有无蓝色沉淀(或滴入酸性高锰酸钾溶液,振荡,观察溶液紫色是否褪去等合理答案) 调节溶液pH以除去Fe3+、Al3+ 12 含有 
【解析】(1)草酸根离子C2O42-,所以Co的化合价为+2价;正确答案:+2。
(2)加入稀硫酸后,二氧化硅不与酸反应,滤渣为二氧化硅及微溶物硫酸钙;含钴催化剂废料(含Fe3O4、Co2O3、Al2O3、CaO及SiO2,加入稀硫酸后,生成硫酸亚铁溶液、硫酸铁溶液、硫酸钴溶液、硫酸铝溶液;所以,滤液含有:Fe2+ Fe3+ Co3+ Al3+ H+ Ca2+等6种阳离子;滤渣为SiO2、CaSO4。正确答案:SiO2和CaSO4 ; 6 。
中含有6种阳离子。
(3)氯酸钠溶液把亚铁离子氧化为铁离子,本身还原为氯离子;反应的离子方程式为:. 6Fe2++6H++ClO3-=6Fe3++Cl-+3H2O;检验亚铁离子是否完全氧化为铁离子方法,加入酸性高锰酸钾溶液,如果溶液不褪色,氧化完全;正确答案:取少量上层清液,向其中滴加K3[Fe(CN)6]溶液,观察有无蓝色沉淀(或滴入酸性高锰酸钾溶液,振荡,观察溶液紫色是否褪去等合理答案)。
(4)步骤④加Na2CO3溶液的目的是,调整溶液的pH,使铁离子变为沉淀而除去;滤渣2中含有Na2Fe6(S04)4(OH)x,根据化合价法则:Na元素为+1价、Fe为+3价、S042-为-2价,OH-为-1价,所以x=12;根据流程图看出,铝离子也已经沉淀,所以包含Al(OH)3沉淀;正确答案:调节溶液pH以除去Fe3+ ; 12 ; 含有。
(5)根据题给信息,钴元素的量守恒,得到产品的产率为(m2÷241×3)÷(m1×35%÷166) ×2×100%;正确答案:


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案