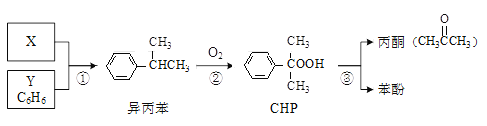
题目内容
【题目】I.实验室可用如下装置(略去部分夹持仪器)制取SO2并验证其性质。
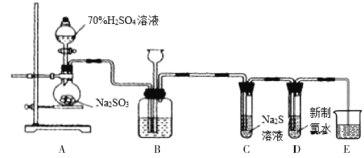
(1)盛装亚硫酸钠的仪器名称为________,若将亚硫酸钠改为铜片,与浓硫酸反应制取SO2,还缺少的仪器有_______,写出用铜片制取SO2的化学方程式_________________________。
(2)装置B的作用之一是通过观察产生气泡的多少判断SO2生成的快慢,其中的液体最好选择___________(填代号)。
a.饱和Na2CO3溶液 b.NaOH溶液 c.饱和NaHCO3溶液 d.饱和NaHSO3溶液
(3)验证SO2的还原性。取充分反应后装置D中的溶液,将其分成三份,分别进行如下实验:
方案I:第一份溶液中滴入AgNO3溶液,有白色沉淀生成;
方案II:第二份溶液中滴入品红溶液,红色褪去;
方案III:第三份溶液中滴入BaCl2溶液,产生白色沉淀。
上述方案合理的是___________(填“方案I”、“方案II”或“方案III”);对不合理的方案作出简要评价___________(如果认为都合理,可以不作答)。
II.已知2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,若采用该方案制备Cl2并验证Cl2的性质。B、C、D中的试剂依次为:饱和食盐水、FeCl2溶液、石蕊溶液。
(4)C中反应的离子方程式为:_________________________________。
(5)D中可能观察到的现象为:_________________________________。
(6)装置E中盛放NaOH溶液,其目的是_________________________________,该反应的化学方程式是:_________________________________。
【答案】圆底烧瓶 酒精灯、石棉网 Cu+2H2SO4![]() CuSO4+SO2↑+2H2O d III 方案I:反应前后的溶液中均有氯离子,可以与硝酸银溶液反应生成白色沉淀,无法通过该方案证明二氧化硫具有还原性;方案II:加人品红溶液,红色褪去,说明溶液中含有HClO或SO2,不能证明二氧化硫具有还原性; 2Fe2++Cl2=2Fe3++2Cl- 先变红后褪色 除去多余氯气,防止污染 ;2NaOH+Cl2=NaCl+ NaClO+H2O
CuSO4+SO2↑+2H2O d III 方案I:反应前后的溶液中均有氯离子,可以与硝酸银溶液反应生成白色沉淀,无法通过该方案证明二氧化硫具有还原性;方案II:加人品红溶液,红色褪去,说明溶液中含有HClO或SO2,不能证明二氧化硫具有还原性; 2Fe2++Cl2=2Fe3++2Cl- 先变红后褪色 除去多余氯气,防止污染 ;2NaOH+Cl2=NaCl+ NaClO+H2O
【解析】
(1)根据装置图分析盛装亚硫酸钠的仪器名称;铜与浓硫酸反应需要加热;铜片与浓硫酸反应生成硫酸铜、二氧化硫和水;
(2)SO2和水反应生成亚硫酸,为防止SO2溶解,应该选取NaHSO3洗气;
(3)SO2被氧化生成SO42-,若验证二氧化硫的还原性,只要证明溶液中含有SO42-即可;
(4)C中FeCl2溶液和氯气反应生成氯化铁;
(5)氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性;
(6)装置E中盛放NaOH溶液,氢氧化钠与氯气反应生成氯化钠、次氯酸钠和水。
(1)根据装置图,盛装亚硫酸钠的仪器名称为圆底烧瓶;铜与浓硫酸反应需要加热,若将亚硫酸钠改为铜片,与浓硫酸反应制取SO2,还缺少的仪器有酒精灯、石棉网;铜片与浓硫酸反应生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)SO2和水反应生成亚硫酸,为防止SO2溶解,应该选取NaHSO3洗气,NaHCO3溶液、NaOH溶液、饱和Na2CO3溶液都可以吸收二氧化硫,所以不能选取abc,故选d;
(3)方案I:氯水中本身就含有Cl-,滴入AgNO3溶液,有白色沉淀生成,不能证明二氧化硫具有还原性,所以方案I不合理;
方案II:氯水具有漂白性,次氯酸、SO2都能使品红褪色,第二份溶液中滴入品红溶液,红色褪去,不能证明二氧化硫具有还原性,所以方案II不合理;
方案III:第三份溶液中滴入BaCl2溶液,产生白色沉淀,沉淀一定是硫酸钡,说明SO2被氧化生成SO42-,能证明二氧化硫具有还原性,所以方案III合理;
(4)C中FeCl2溶液和氯气反应生成氯化铁,反应的化学方程式是2Fe2++Cl2=2Fe3++2Cl-;
(5)氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,D中的现象是溶液先变红后褪色;
(6)装置E中盛放NaOH溶液,氢氧化钠与氯气反应生成氯化钠、次氯酸钠和水,所以装置E中盛放NaOH溶液的目的是尾气处理,防止污染,反应的化学方程式是2NaOH+Cl2=NaCl+ NaClO+H2O。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】已知1L无色待测液中除含有0.2mo/L的Na+外,还可能含下列离子中的一种或几种:
阳离子 | K+、NH4+、Ca2+、Ba2+、Fe3+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO42- |
现进行如图实验操作(每次实验所加试剂均过量)
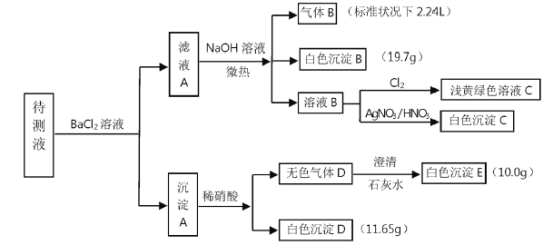
(1)由气体B可确定待测液中含有的离子是___________。
(2)由白色沉淀D和白色沉淀E可以判定待测液中一定含有的离子是___________,据此可以确定待液中一定不存在的离子是___________。
(3)由白色沉淀B可确定待测液中含有的离子是___________。
(4)某同学认为待液中一定不含溴离子,判断的依据是______________________。
(5)综上分析,待测液中K+的最小浓度为___________。
【题目】根据下列实验事实得出的相应结论正确的是( )
选项 | 实验事实 | 结论 |
A | NH3 的水溶液可以导电 | NH3 是电解质 |
B | SO2 通入硝酸钡溶液出现白色沉淀 | BaSO3 不溶于强酸 |
C | 浓硝酸久置发黄 | 硝酸不稳定 |
D | 浓硫酸能脱去胆矾晶体中的水 | 浓硫酸具有脱水性 |
A.AB.BC.CD.D