题目内容
【题目】氨和肼(N2H4)既是一种工业原料,又是一种重要的化工产品。
(1)等物质的量的氨和肼分别与足量的二氧化氮反应,产物为氮气和水。则转移电子数目之比为_______。
(2)肼在一定条件下可发生分解反应:3N2H4(g) ![]() N2(g)+4NH3(g),己知断裂1mol N―H、N―N、N≡N分别需要吸收能量390.8kJ、193 kJ、946 kJ。则该反应的反应热△H=______kJ/mol。
N2(g)+4NH3(g),己知断裂1mol N―H、N―N、N≡N分别需要吸收能量390.8kJ、193 kJ、946 kJ。则该反应的反应热△H=______kJ/mol。
(3)氨的催化氧化过程主要有以下两个反应:
(i)4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H=-905.5kJ/mol
4NO(g)+6H2O(g) △H=-905.5kJ/mol
(ii)4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H=-1267 kJ/mol
2N2(g)+6H2O(g) △H=-1267 kJ/mol
①一定温度下,在2L密闭容器中充入10/3mol NH3与3mol O2发生反应(ii),达到平衡后测得容器中NH3的物质的量为2mol;则反应(ii)的化学平衡常数K=_________;维持温度和体积不变,向反应(ii)中再充入10/3mol NH3与3mol O2,达平衡后,N2(g)的体积分数将__________(填变大、变小、不变)。
②测得温度对NO、N2产率的影响如下图所示。下列说法错误的是_________。
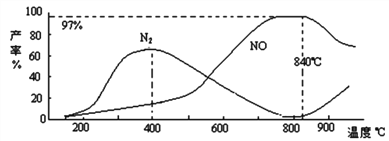
A.升高温度,反应(i)和(ii)的平衡常数均增大
B.840 ℃后升高温度,反应(i)的正反应速率减小,反应(ii)的正反应速率增大
C.900℃后,NO产率下降的主要原因是反应(i)平衡逆向移动
D.800℃左右时,氨的催化氧化主要按照反应(i)进行
(4)N2H4-O2燃料电池是一种高效低污染的新型电池,其结构如图所示:
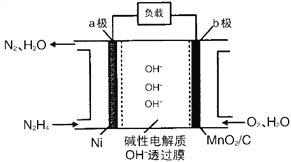
a极的电极反应方程式为______________; b极的电极反应为____________________。
【答案】 3:4 -367 1/9 变小 AB N2H4 -4e-+4OH-=N2+4H2O O2+4e-+2H2O=4OH-
【解析】(1)氨和肼(N2H4)中氮元素化合价分别是-3价和-2价,氮气中氮元素是0价,则等物质的量的氨和肼分别与足量的二氧化氮反应,产物为氮气和水,转移电子数目之比为3:4。(2)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则该反应的反应热△H=(3×4×390.8 +3×193-946-4×3×90.8)kJ/mol=-367kJ/mol。(3)①根据方程式可知
4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
起始浓度(mol/L) 5/3 1.5 0 0
转化浓度(mol/L) 2/3 0.5 1/3 1
平衡浓度(mol/L) 1 1 1/3 1
所以化学平衡常数K=![]()
维持温度和体积不变,向反应(ii)中再充入10/3mol NH3与3mol O2,相当于增大压强,平衡向体积减小的逆反应方向进行,达平衡后,N2(g)的体积分数将变小。②A.反应均是放热反应,升高温度,反应(i)和(ii)的平衡常数均减小,A错误;B.840 ℃后升高温度,正反应速率均增大,B错误;C.900℃后,NO产率下降的主要原因是反应(i)平衡逆向移动,C正确;D.800℃左右时NO含量最高,氮气含量很小,说明氨的催化氧化主要按照反应(i)进行,D正确,答案选AB。(4)a极生成氨气,说明肼失去电子发生氧化反应,电极反应方程式为N2H4 -4e-+4OH-=N2+4H2O;b极是阴极,氧气得到电子,电极反应为O2+4e-+2H2O=4OH-。

【题目】为实现实验目的,选用的装置、实验操作均正确的是( )
实验目的 | 实验步骤和装置 | |
A | 验证SO2具有漂白性 | 将SO2通入氢氧化钠的酚酞试液中 |
B | 探究温度对反应速率的影响 | 不同温度下,取0.1 mol/LKI 溶液,向其中先加入淀粉溶液,再加入0.1 mol/L 硫酸,记录溶液出现蓝色的时间 |
C | 验证牺牲阳极的阴极保护法 |
往铁电极附近滴加铁氰化钾溶液 |
D | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的Cu(OH)2,加热3-5min。 |
A. A B. B C. C D. D