题目内容
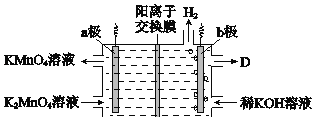
【题目】某同学用下列装置制备并检验Cl2的性质。下列说法正确的是
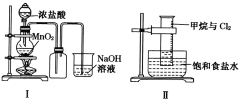
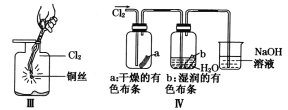
A. I图中:如果MnO2过量,浓盐酸就可全部被消耗
B. II图中:量筒中发生了加成反应
C. III图中:生成蓝色的烟
D. IV图中:湿润的有色布条能褪色将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
【答案】D
【解析】
A. I图中:如果MnO2过量,浓盐酸随着反应进行,浓度减小到一定程度,不再与二氧化锰继续反应,所以盐酸不能被全部消耗,故A错误;
B. II图中:甲烷和氯气在光照条件发生取代反应,不是加成反应,故B错误;
C.Cu在Cl2中剧烈燃烧,产生大量棕色的烟,故C错误;
D.Ⅳ图中:湿润的有色布条能褪色,是因为氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,可使有色布条褪色,剩余氯气通入到盛氢氧化钠溶液的烧杯中发生反应为,Cl2+2NaOH=NaCl+NaClO+H2O,将硫酸溶液滴入烧杯中,至溶液显酸性,氯化钠和次氯酸钠会发生氧化还原反应生成Cl2,故D正确;
故选D。

【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是___________________________________________。
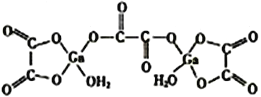
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。
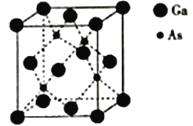
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。
【题目】25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质的溶液,pH由大到小的顺序是___________(填编号)。
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是_______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图。则HX的电离常数___________(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中水电离出来的c(H+)_________(填“大于”、“等于”或“小于”)醋酸溶液水电离出来的c(H+)。

(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=_______________________(填准确数值)。
(5)电离平衡常数是用实验的方法测定出来的,现已经测得25℃时c mol/L的HX的电离度为a,试表示该温度下HX的电离平衡常数K=_____________________。(用含“ c、a的代数式表示”)
【题目】已知部分弱酸的电离平衡常数如下表所示:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数Ka(25℃) | 1.75×10-5 | 2.98×10-8 | Ka1=4.3×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-7 Ka2=1.02×10-7 |
下列离子方程式正确的是
A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-==CO32-+2HClO
B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-==SO32-+2HCO3-
C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-==CaSO3↓+2HClO
D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-==CO2↑+H2O