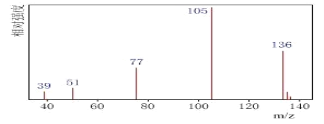
题目内容
【题目】常温下,向1L pH=10的NaOH溶液中持续通入CO2。通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(![]() )的关系如图所示。下列叙述正确的是
)的关系如图所示。下列叙述正确的是
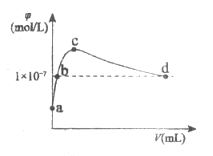
A.a点溶液:水电离的c(OH-)=1×10-4mol/L
B.b点溶液:c(OH-)=c(H+)
C.c点溶液:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D.d点溶液:c(Na+)>2c(CO32-)+c(HCO3-)
【答案】C
【解析】
NaOH溶液中持续通入CO2,先发生反应2NaOH+CO2=Na2CO3+H2O,然后发生Na2CO3+H2O+ CO2=2NaHCO3,继续通入二氧化碳,发生CO2+H2O=H2CO3;碳酸钠的水解程度要大于碳酸氢钠的水解程度,所以当水的电离程度达到最大值时溶液中的溶质为Na2CO3。
A.a点溶液为NaOH溶液,水电离出的c(H+)=10-pH=1×10-10mol/L,水电离出的氢离子浓度和氢氧根浓度相等,所以水电离出的c(OH-)=1×10-10mol/L,故A错误;
B.c点二氧化碳和NaOH完全反应生成Na2CO3,则b溶液中的溶质为Na2CO3和NaOH,溶液显碱性,所以c(OH-)>c(H+),故B错误;
C.c点溶液中的溶质为Na2CO3,存在物料守恒c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故C正确;
D.d点水电离出氢氧根浓度为10-7mol/L,水的电离既不受到促进也不受到抑制,则此时溶液中的溶质应为NaHCO3和H2CO3,溶液应为中性,溶液中存在电荷守恒c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),溶液呈中性,则c(H+)=c(OH-),两式相减得:c(Na+)=2c(CO32-)+c(HCO3-),故D错误;
故答案为C。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】如图是闪锌矿(主要成分是ZnS,含有少量FeS)制备ZnSO4·7H2O的一种工艺流程:闪锌矿粉→溶浸→除铁→结晶→ZnSO47H2O。已知:相关金属离子浓度为0.1mol/L时形成氢氧化物沉淀的pH范围如表:
金属离子 | Fe3+ | Fe2+ | Zn2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 |
(1)闪锌矿在溶浸之前会将其粉碎,其目的是_____________。
(2)溶浸过程使用过量的Fe2(SO4)3溶液和H2SO4浸取矿粉,发生的主要反应是:ZnS+2Fe3+=Zn2++2Fe2++S。
①浸出液中含有的阳离子包括Zn2+、Fe2+、_____________。
②若改用CuSO4溶液浸取,发生复分解反应,也能达到浸出锌的目的,写出离子方程式_____________。
(3)工业除铁过程需要控制沉淀速率,因此分为还原和氧化两步先后进行,如图。还原过程将部分Fe3+转化为Fe2+,得到pH小于1.5的溶液。氧化过程向溶液中先加入氧化物a,再通入O2。下列说法正确的是_____________(填序号)。
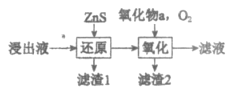
A. 氧化物a可以是ZnO
B. 滤渣2的主要成分是Fe(OH)2
C. 加入ZnS的量和通入O2的速率都可以控制溶液中的c(Fe3+)