题目内容
某学生用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的稀硫酸,其操作可分解为如下几步:
| A.取20.00mL待测硫酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液 |
| B.用标准氢氧化钠溶液润洗滴定管2~3次 |
| C.把盛有标准氢氧化钠溶液碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL |
F.把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
(1)正确操作步骤的顺序为 (填序号);
(2)上述B步骤操作目的是 ;
(3)判断到达滴定终点的现象是 ;
(4)①达到滴定终点后发现碱式滴定管尖嘴部分有气泡,测定结果会 (填“偏大”“偏小”或“无影响”,下同);
②取待测硫酸溶液的酸式滴定管用蒸馏水洗涤后没有用该硫酸溶液润洗,测定结果会 ;
(5)请在右边的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分):

(6)完成3次平行实验,平均消耗标准氢氧化钠溶液体积为20.20mL,则待测液的物质的量浓度为 mol·L-1。
(1)ABDCEF(或BDCEAF)(1分)
(2)防止滴定管内残留的蒸馏水稀释标准氢氧化钠溶液(2分)
(3)溶液由无色恰好变成浅红色,且半分钟内不褪色(1分)
(4)①偏小 ②偏小(各1分)
(5) (2分)
(2分)
(6)0.05050(2分)
解析试题分析:(1)正确的操作位:ABDCEF(或BDCEAF);(2)防止滴定管内残留的蒸馏水稀释标准氢氧化钠溶液;(3)当滴加最后一滴时,溶液由无色恰好变成浅红色,且半分钟内不褪色(1分)
(4)①达到滴定终点后发现碱式滴定管尖嘴部分有气泡,由于气泡占据了一定体积,导致测得氢氧化钠体积偏小,代入计算后测定结果会偏小 ②取待测硫酸溶液的酸式滴定管用蒸馏水洗涤后没有用该硫酸溶液润洗,待测硫酸被稀释,浓度减小而体积不变,消耗氢氧化钠的体积偏小,测定结果会偏小;
(5)
(6)根据关系式2NaOH---------H2SO4可得
考点:考查酸碱中和滴定及误差分析。

我国某大型电解铜生产企业,其冶炼工艺中铜、硫回收率达到97%、87%。下图表示其冶炼加工的流程: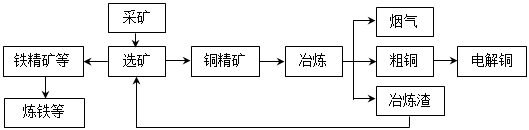
冶炼中的主要反应:Cu2S + O2 =" 2Cu" + SO2
(1)烟气中的主要废气是________________,从提高资源利用率和减排考虑,其综合利用方式是制___________。
(2)电解法炼铜时,阳极是____________(填“纯铜板”或“粗铜板”);粗铜中含有的金、银以单质的形式在电解槽_______________(填“阳极”或“阴极”的槽底,阴极的电极反应式是_________________________________________。
(3)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。
几种物质的溶度积常数(KSP):
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| KSP | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
调节电解液的pH是除去杂质离子的常用方法。根据上表中溶度积数据判断,含有等物质的量浓度的Fe2+、Zn2+、Fe3+、Cu2+的溶液,随pH升高最先沉淀下来的离子是______________。
一种方案是先加入过量的H2O2,再调节pH到4左右。加入H2O2后发生反应的离子方程式为___________________________________________________________________________。
(14分)
氢溴酸在工业和医药领域中有着广泛的用途,下图是某兴趣小组模拟工厂制备氢溴酸粗品并精制的流程如下:
(1)混合①使用冰水的目的是 ;
(2)操作II和III的名称是 , ;
(3)混合②中发生反应的离子方程式为 ;
(4)工业上用氢溴酸和大理石制得溴化钙中含有少量Al3+、Fe3+杂质,加入适量的试剂 (填化学式)后控制溶液的PH约为8.0即可除去杂质,控制溶液的PH约为8.0的目的是_______________________________________________________;
(5)t℃时,将HBr通入AgNO3溶液中生成的AgBr在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgCl的Ksp=4×l0-10,下列说法不正确的是 ( )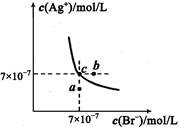
| A.向含有Cl-和Br- 的混合液中滴加硝酸银溶液,一定先产生AgBr的沉淀 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数Κ≈816 AgBr(s)+Cl-(aq)平衡常数Κ≈816 |
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据。
(1)为了准确绘制上图,在滴定开始时和________,滴液速度可以稍快一点,测试和记录pH的间隔可大些;当接近________时,滴液速度应该慢一些,尽量每滴一滴就测试一次。
(2)在图中A的pH范围使用的指示剂是____________;C的pH范围使用的指示剂是________________;D区域为________________。
(3)用0.1 032 mol·L-1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如下表所示:
| 实验序号 | 消耗0.1 032 mol·L-1的盐酸溶液的体积/mL | 待测氢氧化钠溶液的体积/mL |
| 1 | 28.84 | 25.00 |
| 2 | 27.83 | 25.00 |
| 3 | 27.85 | 25.00 |
则待测氢氧化钠的物质的量浓度是________mol·L-1。在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将________(填“偏高”、“偏低”或“不影响”)。
(4)下列关于上述中和滴定过程中的操作正确的是________(填字母)。
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量简量取
实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
| 实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 | 20.00 | 0.10 | 24.18 |
| 2 | 20.00 | 0.10 | 23.06 |
| 3 | 20.00 | 0.10 | 22.96 |
(1)滴定达到终点的标志是 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留小数点后叁位)。
(3)若滴定结束时,碱式滴定管中的液面如图所示,终点读数为 mL。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
实验题
(1)烧碱在保存过程会部分变质(杂质主要为Na2CO3)。
准确称取5.0g样品配制成250mL溶液,各取配制好的烧碱溶液10.00mL于锥形瓶中,分别向锥形瓶中各加入1~2滴酚酞指示剂,(已知:酚酞变色时,此时只有NaOH与HCl反应,Na2CO3还没有与HCl反应)用浓度为0.20mol·L-1的盐酸标准液进行滴定。相关数据记录如下:
| 实验编号 | V(烧碱溶液)/mL | V(盐酸)/mL | |
| 初始读数 | 末尾读数 | ||
| 1 | 10.00 | 0.50 | 21.52 |
| 2 | 10.00 | 1.00 | 21.98 |
| 3 | 10.00 | 0.20 | 24.80 |
试回答:
①滴定时右手的正确操作是______________________________________。
②判断到达滴定终点的实验现象是__________________________________________,依据表中数据,计算出烧碱样品中含NaOH的质量分数为______ _%。
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是__________。
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.滴定过程中振荡锥形瓶时,有少量待测溶液溅出
D.滴定前平视读数,滴定结束仰视读数
(2)氧化还原滴定实验同中和滴定类似。过氧化氢是重要的氧化剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度。已知:2KMnO4+5H2O2+6H2SO4===2MnSO4+8H2O+5O2↑,请填写下列空白:
①用 (填“酸式”或“碱式”)滴定管移取过氧化氢溶液25.00 mL至锥形瓶中,作被测试样。
②滴定时,将高锰酸钾标准溶液注入酸式滴定管中,高锰酸钾标准溶液用酸式滴定管原因为 。③重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的物质的量浓度为 。
为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是 
| A.正极的电极方程式为:O2+2H2O+4e-===4OH- |
| B.将石墨电极改成Mg电极,难以观察到铁锈生成 |
| C.若向自来水中加入少量NaCl(s),可较快地看到铁锈 |
| D.向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得快 |