题目内容
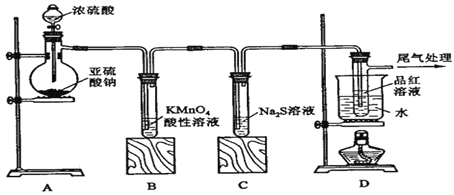
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是______________,其中发生反应的化学方程式为_______________________________________________________________;
(2)实验过程中,装置B、C中发生的现象分别是___________、___________,这些现象分别说明SO2具有的性质是__________和___________;装置B中发生反应的离子方程式为_______________________________________________________________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_____________________________;
(4)尾气可采用_____________溶液吸收。
【答案】 蒸馏烧瓶 Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 溶液由紫红色变为无色 无色溶液中出现黄色浑浊 还原性 氧化性 ![]() 品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色 NaOH
品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色 NaOH
【解析】试题分析:该实验为制备SO2并检验其性质,则A为SO2的发生装置,B、C、D为检验装置;B中为酸性高锰酸钾溶液。它具有强氧化性能把SO2氧化成H2SO4,它本身被还原为Mn2+,溶液的紫色变浅或褪去。故可用于检验SO2的还原性;C中为硫化钠溶液,其具有强还原性二者发生反应产生难溶于水的S单质,看见溶液变浑浊,故可用于检验SO2的氧化性;D中为品红溶液,可检验SO2的漂白性;SO2的漂白是结合漂白,产生的无色物质不稳定,受热容易分解而恢复原来的红色。SO2是大气污染物,它是酸性氧化物,可用碱性溶液NaOH来消除其危害。

【题目】将质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06g·cm-3)用铂电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是( )
质量分数 | NaOH的 | 阳极析出物的质量/g | 阴极析出物的质量/g |
A | 6.2% | 19 | 152 |
B | 6.2% | 152 | 19 |
C | 4.2% | 1.2 | 9.4 |
D | 4.2% | 9.4 | 1.2 |
A. A B. B C. C D. D