题目内容
【题目】碳的化合物与人类生产、生活密切相关。
(1)标准状况下,将11.2LCO2通入100mL 1mol/L的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为___________;用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+______。
②c(H+)+c(Na+)=_________。
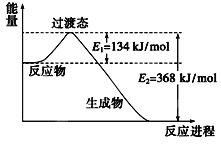
(2)下图是1mol NO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________
(3)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),
Ni(CO)4(g),![]() H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是________(填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是________(填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,![]() H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v正[Ni(CO)4]=v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(4)二甲醚催化重整制氢的反应过程,主要包括以下几个反应(以下数据为25℃、1.01×105Pa测定):
①CH3OCH3(g)+H2O(l)![]() 2CH3OH(l)△H=+24.52kJ/mol
2CH3OH(l)△H=+24.52kJ/mol
②CH3OH(l)+H2O(l)![]() CO2(g)+3H2(g)△H=+49.01kJ/mol
CO2(g)+3H2(g)△H=+49.01kJ/mol
③CO(g)+H2O(l)![]() CO2(g)+H2(g)△H=-41.17kJ/mol
CO2(g)+H2(g)△H=-41.17kJ/mol
④CH3OH(l)![]() CO(g)+2H2(g)△H=+90.1kJ/mol
CO(g)+2H2(g)△H=+90.1kJ/mol
工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如下图所示,
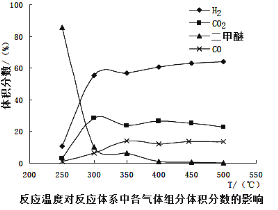
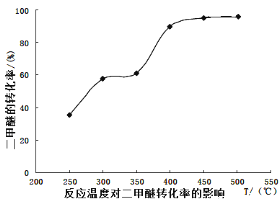
①你认为反应控制的最佳温度应为___________。
A.300~350℃B.350~400℃C.400~450℃D.450~500℃
②在温度达到400℃以后,二甲醚与CO2以几乎相同的变化趋势明显降低,而CO、H2体积分数也以几乎相同的变化趋势升高,分析可能的原因是___________(用相应的化学方程式表示)。
【答案】 c(Na+)>c(CO2-3)>c(OH-)>c(HCO-3)>c(H+) c(H+)+c(HCO-3) 2c(CO2-3)+c(HCO-3)+c(OH-) NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol-1 C C 可能发生另一种重整制氢反应:CH3OCH3 +CO2 ![]() 3H2+3CO
3H2+3CO
【解析】(1)标准状况下,1.12L CO2的物质的量为:![]() =0.05mol,氢氧化钠的物质的量为:1molL-1×0.1L=0.1mol,二者恰好完全反应生成碳酸钠,由CO32-+H2OHCO3-+OH-可知:c(Na+)最大,水解很微弱,因此c(CO32-)>c(OH-)>c(HCO-3),溶液显碱性c(H+)最小,因此碳酸钠溶液中离子浓度大小顺序为:c(Na+)>c(CO2-3)>c(OH-)>c(HCO-3)>c(H+);
=0.05mol,氢氧化钠的物质的量为:1molL-1×0.1L=0.1mol,二者恰好完全反应生成碳酸钠,由CO32-+H2OHCO3-+OH-可知:c(Na+)最大,水解很微弱,因此c(CO32-)>c(OH-)>c(HCO-3),溶液显碱性c(H+)最小,因此碳酸钠溶液中离子浓度大小顺序为:c(Na+)>c(CO2-3)>c(OH-)>c(HCO-3)>c(H+);
①碳酸钠溶液中,水电离出的氢离子部分与CO32-结合生成H2CO3和HCO3-,溶液中质子守恒:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+);
②碳酸钠溶液中,电荷守恒:c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-);
(2)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJmol-1;
(3)A.Ni是固体,浓度为常数,改变用量对平衡无影响,反应物的转化率不变,故A错误;B.一定温度下给定的化学方程式的△H不会随着平衡移动而改变,只与方程式的书写方式有关,故B错误;C.因外界条件为恒温恒容、Ni是固体且正反应为气体体积缩小的反应,所以反应达到平衡后充入CO,相当于在恒温恒压条件下达平衡后又加压,平衡右移,CO的转化率提高,平衡后其体积分数降低,故C正确;D.速率关系未说明正、逆,不能判断是否已达平衡;因该反应气体质量增加而容积不变,所以混合气体密度是一个变量,当不变时说明反应达平衡,故D错误;故答案为C;
(4)①由图可知在400-450℃时,二甲醚的浓度最小,转化率最大,故答案为C;
②温度超过400℃,二甲醚与二氧化碳相同的比例降低,CO与氢气相同的比例升高,说明二甲醚与二氧化碳以1:1反应,生成CO与氢气的比例相同,则反应的方程式为:CH3OCH3+CO2![]() 3H2+3CO。
3H2+3CO。