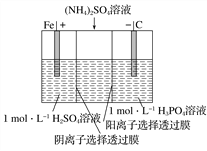
题目内容
【题目】甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1 mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。请回答下列问题:
(1)戊离子的结构示意图为________。
(2)写出乙的单质的电子式:________。
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2∶4,反应中被氧化的物质与被还原的物质的物质的量之比为________。
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:____________。
(5)按图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:____________。
【答案】 ![]()
![]() 2∶3 H++AlO
2∶3 H++AlO![]() +H2O===Al(OH)3↓ NaCl+H2O
+H2O===Al(OH)3↓ NaCl+H2O![]() NaClO+H2↑
NaClO+H2↑
【解析】甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝,则X为NH3,甲为H,乙为N;甲、丙处于同一主族,结合原子序数可知,丙为Na;丙、丁、戊处于同一周期,即处于第三周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和,即戊原子最外层电子数为1+1+5=7,则戊为Cl;氯气与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1,则Y为NH4Cl,Z为HCl;丁的单质既能与丙(Na)元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z(HCl)的水溶液反应生成盐,丁为两性金属,则丁为Al元素,故L为NaAlO2;丙、戊组成化合物M为NaCl。
(1)氯离子的结构示意图为![]() ;(2)氮气的电子式为
;(2)氮气的电子式为![]() ;(3)氯气与氨气反应生成NH4Cl、HCl,二者物质的量之比为2:4,该反应方程式为:3Cl2+4NH3=N2+2NH4Cl+4HCl,反应中被氧化的物质是2mol氨气,被还原的物质是3mol氯气,物质的量之比为2:3;(4)将少量的盐酸滴入过量NaAlO2溶液中发生反应的离子方程式为:AlO2-+H++H2O=Al(OH)3↓;(5)电解饱和氯化钠溶液的的方程式为:NaCl+2H2O
;(3)氯气与氨气反应生成NH4Cl、HCl,二者物质的量之比为2:4,该反应方程式为:3Cl2+4NH3=N2+2NH4Cl+4HCl,反应中被氧化的物质是2mol氨气,被还原的物质是3mol氯气,物质的量之比为2:3;(4)将少量的盐酸滴入过量NaAlO2溶液中发生反应的离子方程式为:AlO2-+H++H2O=Al(OH)3↓;(5)电解饱和氯化钠溶液的的方程式为:NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,同时发生反应Cl2+2NaOH=NaCl+NaClO+H2O,故该电解池中发生反应的总反应方程式为:NaCl+H2O
2NaOH+Cl2↑+H2↑,同时发生反应Cl2+2NaOH=NaCl+NaClO+H2O,故该电解池中发生反应的总反应方程式为:NaCl+H2O![]() NaClO+H2↑。
NaClO+H2↑。