题目内容
(1)在标准状况下,44.8L的NH3气体质量为______ g,其中含______个氢原子,其中含______molN; 将其溶于水配成200mL的溶液,其物质的量浓度为______ mol/L.
(2)等物质的量的CH4和NH3两种气体中,H原子数之比为______,二者的质量之比为______,在同温同压下的体积之比为______.
解:(1)m=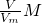 =
= ×17g/mol=34g,氨气的物质的量=
×17g/mol=34g,氨气的物质的量=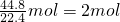 ,氨气分子个数=2NA,一个氨气分子中含有3个氢原子,所以氨气中含有6NA个氢原子,含有2mol氮原子,C=
,氨气分子个数=2NA,一个氨气分子中含有3个氢原子,所以氨气中含有6NA个氢原子,含有2mol氮原子,C= =
=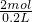 10mol/L,
10mol/L,
故答案为:34; 6NA; 2; 10;
(2)一个甲烷分子中含有4个氢原子,一个氨气分子中含有3个氢原子,等物质的量的CH4和NH3两种气体其分子数相同,所以等物质的量的CH4和NH3两种气体中,H原子数之比为4:3,m(CH4):m(NH3)=nM(CH4):nM(NH3)=16:17,V(CH4):V(NH3)=nVm:nVm=1:1,
故答案为:4:3; 16:17; 1:1.
分析:(1)根据m=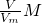 计算氨气的质量,结合氨气分子的构成计算氢原子个数及氮原子的物质的量,根据C=
计算氨气的质量,结合氨气分子的构成计算氢原子个数及氮原子的物质的量,根据C= 计算溶液的物质的量浓度;
计算溶液的物质的量浓度;
(2)等物质的量的CH4和NH3两种气体其分子数相同,结合分子构成、m=nM、V=nVm计算.
点评:本题考查物质的量的有关计算,明确质量、体积、物质的量的关系即可解答,难度不大.
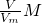 =
= ×17g/mol=34g,氨气的物质的量=
×17g/mol=34g,氨气的物质的量=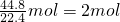 ,氨气分子个数=2NA,一个氨气分子中含有3个氢原子,所以氨气中含有6NA个氢原子,含有2mol氮原子,C=
,氨气分子个数=2NA,一个氨气分子中含有3个氢原子,所以氨气中含有6NA个氢原子,含有2mol氮原子,C= =
=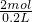 10mol/L,
10mol/L,故答案为:34; 6NA; 2; 10;
(2)一个甲烷分子中含有4个氢原子,一个氨气分子中含有3个氢原子,等物质的量的CH4和NH3两种气体其分子数相同,所以等物质的量的CH4和NH3两种气体中,H原子数之比为4:3,m(CH4):m(NH3)=nM(CH4):nM(NH3)=16:17,V(CH4):V(NH3)=nVm:nVm=1:1,
故答案为:4:3; 16:17; 1:1.
分析:(1)根据m=
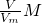 计算氨气的质量,结合氨气分子的构成计算氢原子个数及氮原子的物质的量,根据C=
计算氨气的质量,结合氨气分子的构成计算氢原子个数及氮原子的物质的量,根据C= 计算溶液的物质的量浓度;
计算溶液的物质的量浓度;(2)等物质的量的CH4和NH3两种气体其分子数相同,结合分子构成、m=nM、V=nVm计算.
点评:本题考查物质的量的有关计算,明确质量、体积、物质的量的关系即可解答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列关于气体摩尔体积的几种说法正确的是( )
| A、22.4 L任何气体的物质的量均为1 mol | B、标准状况下,1 mol物质的体积为22.4 L | C、H2、O2、N2、CO2组成的混合气体1 mol在标准状况下的体积约为22.4 L | D、在同温同压下,相同体积的任何气体单质所含分子数和原子数都相同 |
 (1)在标准状况下,气体A的密度为1.25g/L,气体B相对于氢气的密度为21,若8.96LA和B的混合气体的质量为13.44g,则混合物中A与B的体积比为
(1)在标准状况下,气体A的密度为1.25g/L,气体B相对于氢气的密度为21,若8.96LA和B的混合气体的质量为13.44g,则混合物中A与B的体积比为