��Ŀ����
����˵���������ȷ���ǣ� ��
�ٻ���̿��SO2��HClO������Ư�����ã���Ư�Ļ�ѧԭ����ͬ
����100mL0.1mol/L ���廯������Һ��ͨ��0.05mol������ʱ������Ӧ�����ӷ���ʽ��
2Fe2����4Br-��3Cl2="2" Fe3����2Br2��6Cl-
����Ϊ�����ԣ�HClO��ϡH2SO4�����Էǽ����ԣ�Cl��S
������������KIO3��Һ��KI��Һ������Ӧ����I2ʱ�����ӷ���ʽ��
IO3����5I����3H2O=I2��6OH��
��̼��������ӵĵ��뷽��ʽ�ɱ�ʾΪ��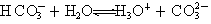
��Ԫ�����ڱ��У����ϵ��£�±��Ԫ�صķǽ�������������±����������μ���
��500�桢30MPa�£���0.5mol N2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)  2NH3 (g) ��H=-38.6kJ��mol-1
2NH3 (g) ��H=-38.6kJ��mol-1
| A��ȫ�� | B���ڢ� | C���ڢۢܢ� | D���ڢܢ� |
B
��������������ٻ���̿��Ư�����������ã����������仯��HClO��Ư����������HClO��ǿ�����ԣ�SO2��Ư����SO2������ɫ�����ʷ����˷�������Ӧ��������ɫ���ʣ�Ư��ԭ����ͬ������FeBr2��Cl2�����ʵ���֮��Ϊ1:5��Cl2���������ӷ���ʽ��ȷ����HClO��ϡ�����������ǿ���ͷǽ������أ��������������£�����������OH?���������ɵ�H3O+ΪH+����ȷ����Ԫ�����ڱ��У����ϵ��£���±�������������ǿ��������ΪN2��H2�ķ�ӦΪ���淴Ӧ������0.5mol N2��1.5mol H2��������ȫ��Ӧ��������?H������
���㣺���⿼��Ư���ԡ����ӷ���ʽ����д���ǽ����ԵıȽϡ�Ԫ�����ʵĵݱ��ԡ�?H�ļ��㡣

 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�����ɫ����Һ�У��ܹ������������������
| A��Cu2+��Na+��SO42-��OH- | B��K+��Na+��HCO3-��NO3- |
| C��OH-��CO32--��Ca2+��Fe3+ | D��Ba2+��Na+��OH-��SO42- |
����ˮ���������H+��Ũ��Ϊ1��10��13mol/L����Һ�У�һ���ܴ���������������ǣ� ��
��K+��Cl����NO3����S2����K+��Fe2+��I����SO42��
��Na+��Cl����NO3����SO42����Na+��Ca2+��Cl����HCO3��
��K+��Ba2+��Cl����NO3��
| A���٢� | B���ۢ� | C���ۢ� | D���ڢ� |
�������ӷ���ʽ����ȷ����
| A����Ba(OH)2��Һ�еμ�NaHSO4��Һ��ǡ��Ϊ���ԣ�Ba2+ + OH- + H+ + SO42-= BaSO4��+ H2O |
B��NH4HCO3��Һ�����KOHŨ��Һ���ȣ�NH4++ OH��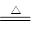 NH3��+ H2O NH3��+ H2O |
| C��ϡ�����������м��Ӧ��3 Fe + 8H+ +2 NO3- =" 3" Fe3+ +2 NO�� + 4 H2O |
| D��KI��Һ��H2SO4�ữ��H2O2��Һ��ϣ�2 I�� + H2O2 + 2 H+ ="2" H2O + I2 |
�������ӷ���ʽ��д��ȷ����
| A��NaAlO2��Һ��ͨ�������CO2��2AlO2�C+3H2O+CO2=2Al(OH)3+CO32�C |
| B��������Һ�еμ�Ba(OH)2��Һ��SO42�Cǡ����ȫ������Al3++Ba2++ SO42�C+3OH�C=BaSO4+Al(OH)3 |
| C��200 mL 2 mol��L�C1��FeBr2��Һ��ͨ��11.2 L��״���µ�������4 Fe2++6Br�C+5Cl2=4Fe3++3Br2+ 10Cl�C |
| D����ǿ����Һ�д���������Fe(OH)3��Ӧ����Na2FeO4��3ClO�C+2Fe(OH)3=2FeO42�C+3Cl�C+H2O+4H+ |
����ʱ�����и���������ָ����Һ�п��Դ���������ǣ� ��
| A��1.0mol/L��KNO3��Һ��H+��Fe2+ ��K+��SO42- |
| B��������Ӧ�ų���������Һ��Na+��CH3COO-��HCO3-��SO42- |
| C�����������Һ�ʺ�ɫ����Һ��NH4+��K+��SO42-��Cl- |
| D��������ˮ�У�NO3-��Na+��SO32-��Cl- |
�ڼ�����Һ���ܴ�����������ҺΪ��ɫ�����������ǣ� ��
| A��K+��MnO4-��Na+��Cl- | B��K+��Na+��NO3-��CO32- |
| C��Na+��H+��NO3-��SO42- | D��Fe3+��Na+��Cl-��SO42- |
�������ӷ���ʽ��д��ȷ���ǣ� ��
| A�����Ȼ�����Һ�м�������İ�ˮ��3NH3?H2O+Al3+=3NH4++ Al(OH)3�� |
| B��NaOH��Һ��������CO2��OH����CO2=HCO3- |
| C�����Ȼ�����Һ�м���ͭ�۷����ķ�Ӧ��Cu+Fe3+= Cu2+ +Fe2+ |
| D��������ˮ�ķ�Ӧ��Cl2+H2O=ClO-+Cl-+ 2H+ |
���з��ӻ�������ָ������Һ��һ���ܴ������ڵ���
| A�������³����Ե���Һ��Fe3+��Na����Cl����SO42�� |
| B��1 mol/L��NaAlO2��Һ��NH3?H2O��CO32����K+��SiO32�� |
| C���������ʷ�Ӧ������������Һ�� Na+��K+��NO3����Mg2+ |
| D����ˮ�������c(H+)��1��10��12mol/L��Һ��HCO3����NO3����Na+��Mg2+ |