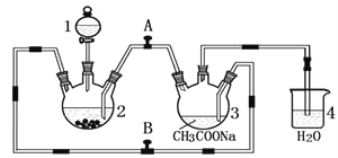
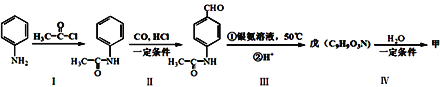
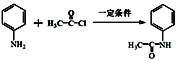题目内容
【题目】已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。

(1)写出下列物质的化学式:A:__________,D:___________,R:_____________。
(2)按要求写下列反应方程式:
H在潮湿空气中变成M的过程中的化学方程式______________________________;
B和Q反应的离子方程式_________________________________________;
D与稀硝酸反应的离子方程式______________________________________________。
(3)检验溶液N中阴离子的方法、现象及离子方程式为_________________________________。
【答案】Na2O2 Fe3O4 Al 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Al2O3+2OH-=2AlO2-+H2O 3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O 取溶液于试管中滴加盐酸,先出现白色沉淀后溶解;AlO2-+H+ +H2O=Al(OH)3↓;Al(OH)3+3H+=Al3++3H2O
【解析】
A为淡黄色固体,且A能与水反应故,即A为Na2O2,T、R为两种常见的用途很广的金属单质,即为Fe和Al,D是具有磁性黑色晶体,即D为Fe3O4,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体,即H为Fe(OH)2,.M为Fe(OH)3,W为FeCl3,C为无色无味的气体,则C为O2,B为NaOH,R为Al,则T为Fe,Q为氧化铝,N为NaAlO2,E为FeCl2和FeCl3;
A为淡黄色固体,且A能与水反应故,即A为Na2O2,T、R为两种常见的用途很广的金属单质,即为Fe和Al,D是具有磁性黑色晶体,即D为Fe3O4,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体,即H为Fe(OH)2,.M为Fe(OH)3,W为FeCl3,C为无色无味的气体,则C为O2,B为NaOH,R为Al,则T为Fe,Q为氧化铝,N为NaAlO2,E为FeCl2和FeCl3;
(1)根据上述分析,A为Na2O2,D为Fe3O4,R为Al;
(2)Fe(OH)2容易被氧气氧化,Fe(OH)2潮湿空气中发生的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;氧化铝为两性氧化物,能与NaOH发生Al2O3+2OH-=2AlO2-+H2O;D为Fe3O4,与稀硝酸发生氧化还原反应,离子方程式为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(3)N为NaAlO2,阴离子为AlO2-,利用氢氧化铝为两性氢氧化物,因此检验AlO2-操作方法是取溶液于试管中滴加盐酸,先出现白色沉淀,继续滴加盐酸,沉淀溶解;AlO2-+H+ +H2O=Al(OH)3↓;Al(OH)3+3H+=Al3++3H2O。

【题目】(1)将0.5 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,该反应的热化学方程式为_______________。又已知:H2O(g)=H2O(l) ΔH2=-44.0 kJ·mol-1,则4.48 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是__________。
(2)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体。已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
键能/ (kJ·mol-1) | 348 | 413 | 436 | 358 | 1 072 | 458 |
则工业制备甲醇的热化学方程式为________________。
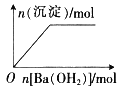
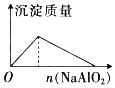
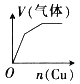
【题目】下列反应中,相关坐标图像错误的是( )
的是
A | B | C | D |
NaHSO4溶液中逐滴加入Ba(OH)2 溶液 | 向盐酸中滴入NaAlO2溶液 | 将铜粉加入到一定量浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
A. AB. BC. CD. D