题目内容
为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
已知:电离平衡常数:
H2S Ka1=1.3×10-7;Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
(1)根据上述实验,可以得出结论:在 条件下,+4价硫的化合物可以氧化-2价硫的化合物.
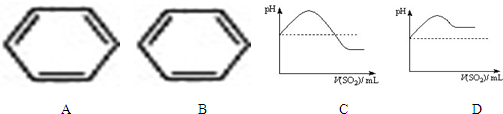
(2)将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是 (填序号).
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应 .
| 实验操作 | 实验现象 | |
| 实验 1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验 2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验 3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
H2S Ka1=1.3×10-7;Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
(1)根据上述实验,可以得出结论:在
(2)将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是

(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应
考点:含硫物质的性质及综合应用
专题:氧族元素
分析:(1)H2S与SO2发生氧化还原反应生成S;
(2)根据H2SO3 酸性比H2S强判断;
(3)如与Ag发生置换反应生成H2,可用点燃的方法检验.
(2)根据H2SO3 酸性比H2S强判断;
(3)如与Ag发生置换反应生成H2,可用点燃的方法检验.
解答:
解:(1)由实验现象可知反应应下酸性条件下发生氧化还原反应生成S,故答案为:酸性(或酸性较强);
(2)H2SO3 酸性比H2S强,通入过量的SO2,溶液酸性更强,pH更小,故答案为:C;
(3)如与Ag发生置换反应生成H2,可用点燃的方法检验,但应先将H2S除去,方法是将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应,
故答案为:将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应.
(2)H2SO3 酸性比H2S强,通入过量的SO2,溶液酸性更强,pH更小,故答案为:C;
(3)如与Ag发生置换反应生成H2,可用点燃的方法检验,但应先将H2S除去,方法是将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应,
故答案为:将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应.
点评:本题考查了物质性质实验方案的设计,侧重于硫化氢与二氧化硫的性质的设计,题目难度不大,注意把握实验原理和实验的基本操作方法的学习.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、AlCl3溶液中滴加足量氨水:Al3++4OH-═AlO2-+2H2O |
| B、氢氧化钙悬浊液中滴加盐酸:H++OH-═H2O |
| C、NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| D、MaSO4溶液中加入Ba(OH)2溶液:SO42-+Ba2+═BaSO4↓ |