题目内容
化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是__________________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为_________、___________。
(3)某化肥厂用NH3制备NH4NO3,已知由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去NH3的质量占耗用全部NH3质量的__________%。
(4)合成氨气是生产氮肥的重要环节。合成氨生产简易流程示意图如下:

从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作___________。合成氨的反应需在500℃进行,其主要原因是_________。
(1)普钙是磷肥,它的有效成分是__________________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为_________、___________。
(3)某化肥厂用NH3制备NH4NO3,已知由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去NH3的质量占耗用全部NH3质量的__________%。
(4)合成氨气是生产氮肥的重要环节。合成氨生产简易流程示意图如下:

从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作___________。合成氨的反应需在500℃进行,其主要原因是_________。
(8分)(1)Ca(H2PO4)2·H2O或Ca(H2PO4)2(1分)
(2)2NH3+CO2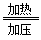 H2NCOONH4(1分)、H2NCOONH4=H2NCONH2+H2O(1分)
H2NCOONH4(1分)、H2NCOONH4=H2NCONH2+H2O(1分)
(3)53.1%(2分)
(4)从原因来讲,许多化学反应是可逆反应,转化率低;从结果来说,循环操作的主要目的在于充分地利用原料、降低成本;从工艺设计来说,循环操作有利于连续化生产、减少工序;从环保角度来说,实现全封闭生产,控制废弃物的排放;此温度下催化剂的活性最高
(2)2NH3+CO2
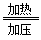 H2NCOONH4(1分)、H2NCOONH4=H2NCONH2+H2O(1分)
H2NCOONH4(1分)、H2NCOONH4=H2NCONH2+H2O(1分)(3)53.1%(2分)
(4)从原因来讲,许多化学反应是可逆反应,转化率低;从结果来说,循环操作的主要目的在于充分地利用原料、降低成本;从工艺设计来说,循环操作有利于连续化生产、减少工序;从环保角度来说,实现全封闭生产,控制废弃物的排放;此温度下催化剂的活性最高
试题分析:(1)普钙的有效成分是磷酸二氢钙,其化学式为Ca(H2PO4)2·H2O或Ca(H2PO4)2。
(2)氨气和二氧化碳在加压、加热条件下反应生成氨基甲酸铵,氨基甲酸铵脱水生成尿素和水,根据原子守恒可知,有关反应的化学方程式为2NH3+CO2
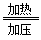 H2NCOONH4、H2NCOONH4=H2NCONH2+H2O。
H2NCOONH4、H2NCOONH4=H2NCONH2+H2O。(3)根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸的物质的量=1mol×96%×92%=0.8832mol。由HNO3+NH3═NH4NO3可知,该反应消耗的氨气的物质的量为0.8832mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数=
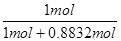 ×100%=53.1%。
×100%=53.1%。(4)从原因来讲,许多化学反应是可逆反应,转化率低;从结果来说,循环操作的主要目的在于充分地利用原料、降低成本;从工艺设计来说,循环操作有利于连续化生产、减少工序;从环保角度来说,实现全封闭生产,控制废弃物的排放;由于在500℃时催化剂的活性最高,所以合成氨的反应需在500℃进行。

练习册系列答案
相关题目
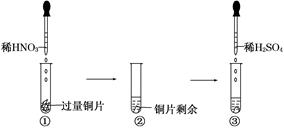

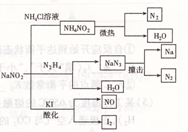
 的化学方程式:______________;___________________。
的化学方程式:______________;___________________。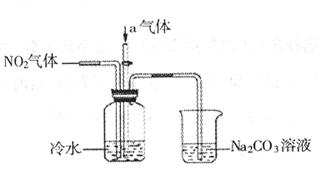
 溶液的烧杯为尾气处理装置,该装置中反应的化学方程式是:
溶液的烧杯为尾气处理装置,该装置中反应的化学方程式是: 代替NO
代替NO