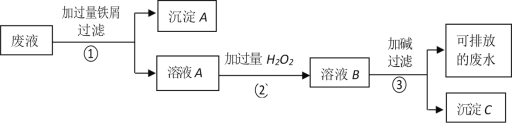
题目内容
【题目】下列条件下,两瓶气体所含原子数一定相等的是( )
A.同质量、同体积的N2和COB.同温度、同体积的H2和N2
C.同体积、同密度的C2H4和C3H4D.同压强、同体积的N2O和CO2
【答案】A
【解析】
A. N2和CO同质量,摩尔质量也相同,根据n=m/M知,二者物质的量相同,分子数相同,这两种分子都属于双原子分子,所以原子数也相同,故A正确;
B.只有在同温、同压、同体积下,H2和N2的物质的量才相等,原子数才相等,故B错误;
C.根据m=ρV可知,同体积、同密度的C2H4和C3H4质量相等,假设C2H4和C3H4质量均为mg,则C2H4中所含原子的物质的量为![]() ,C3H4中所含原子的物质的量为
,C3H4中所含原子的物质的量为![]() ,二者所含原子数不相等,故C错误;
,二者所含原子数不相等,故C错误;
D.只有在同温、同压、同体积下,N2O和CO2的物质的量才相等,原子数才相等,故D错误;
答案:A

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】为探究Na与C02反应产物,某化学兴趣小组按如图装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3

回答下列问题:
(1)写出A中反应的离子方程式_____________________________________;
(2)仪器X的名称是____________________,B中的溶液为_____________________;
(3)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g.再进行下列实验操作,其正确顺序是____________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入C02至E中出现浑浊 e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是______________________________________;
(5)探究固体产物中元素Na的存在形式
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
m1 | m2 | m3 |
66.7g | 69.0g | 72.lg |
(6)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式____________________________________________。