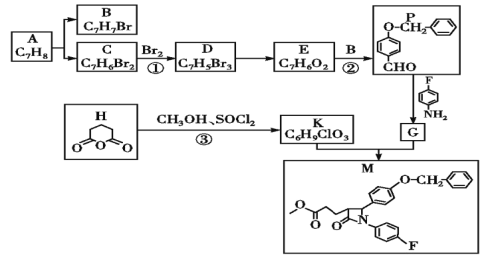
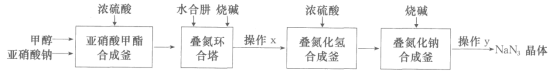
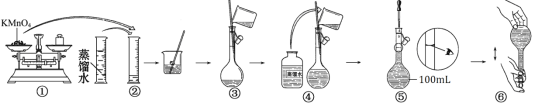
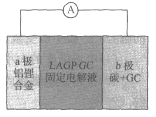
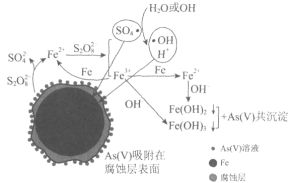
题目内容
【题目】经实验测定某固体样品中只含有Na2O2和Na2CO3。现称取该样品13.1g,加入水充分反应后产生1.12L(标准状况下)气体,所得溶液体积为500mL。试计算:
(1)该样品含有Na2O2的质量分数为_________。
(2)反应后溶液中Na+的物质的量浓度为_________mol/L。
【答案】59.5% 0.60
【解析】
(1)依据方程式:![]() 和标况下气体体积计算Na2O2质量,再通过样品质量计算其质量分数;
和标况下气体体积计算Na2O2质量,再通过样品质量计算其质量分数;
(2)通过样品含有Na2O2的质量分数计算样品中含Na2CO3物质的量,在计算样品中含Na元素物质的量,在利用公式![]() 计算反应后溶液中Na+的物质的量浓度。
计算反应后溶液中Na+的物质的量浓度。
(1)Na2O2与水反生反应:![]() ,则产生气体为氧气,标况下1.12L则其物质的量
,则产生气体为氧气,标况下1.12L则其物质的量![]() ,则Na2O2物质的量n(Na2O2)=2n(O2)=0.1mol,则Na2O2质量
,则Na2O2物质的量n(Na2O2)=2n(O2)=0.1mol,则Na2O2质量![]() ,则Na2O2质量分数
,则Na2O2质量分数![]() ,故答案为:59.5% ;
,故答案为:59.5% ;
(2)样品中Na2CO3质量为13.1g-7.8g=5.3g,则Na2CO3物质的量![]() ,则样品中含Na元素的物质的量
,则样品中含Na元素的物质的量![]() ,Na元素最终变为Na+则反应后溶液中Na+的物质的量浓度
,Na元素最终变为Na+则反应后溶液中Na+的物质的量浓度![]() ,故答案为:0.60。
,故答案为:0.60。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
【题目】下列实验方案中,能达到相应实验目的的是
实验方案 |
|
|
|
|
目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
A. A B. B C. C D. D