题目内容
X、Y、Z为三种短周期元素,X、Y同周期,X、Z的最低价离子分别为X2-、Z-,Y2+与Z-具有相同的电子层结构,下列叙述一定不正确的是( )
| A、它们的原子序数X>Y>Z |
| B、原子最外层上的电子数Z>X>Y |
| C、Z的单质可以从NaBr溶液中置换出Br2 |
| D、X的最高价氧化物对应水化物是强酸 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y2+和Z-具有相同的电子层结构,则Y在Z的下一周期,则Y为Mg元素,Z为F元素,X、Y同周期,则X为S元素,结合元素周期律知识解答该题.
解答:
解:X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y2+和Z-具有相同的电子层结构,则Y在Z的下一周期,则Y为Mg元素,Z为F元素,X、Y同周期,则X为S元素,
A.原子序数由大到小的顺序为X(16)>Y(12)>Z(9),故A正确;
B.X、Y、Z原子最外层上的电子数分别为6、2、7,故B正确;
C.Z为F元素,与水剧烈反应,与NaBr溶液反应生成氧气,故C错误;
D.X为S元素,最高价氧化物对应水化物为硫酸,为强酸,故D正确.
故选C.
A.原子序数由大到小的顺序为X(16)>Y(12)>Z(9),故A正确;
B.X、Y、Z原子最外层上的电子数分别为6、2、7,故B正确;
C.Z为F元素,与水剧烈反应,与NaBr溶液反应生成氧气,故C错误;
D.X为S元素,最高价氧化物对应水化物为硫酸,为强酸,故D正确.
故选C.
点评:本题考查原子结构与元素周期律的关系,为高频考点,侧重于学生的分析能力的考查,题目难度不大,本题的关键是根据原子结构特点正确推断元素的种类.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将10克CH4氧气中完全燃烧,将其产物和足量的过氧化钠充分反应,反应后固体增加的质量是( )
| A、20克 | B、12.5克 |
| C、10克 | D、9克 |
下列烷烃的一氯取代物中没有同分异构体的是( )
①丙烷 ②丁烷 ③异丁烷 ④新戊烷.
①丙烷 ②丁烷 ③异丁烷 ④新戊烷.
| A、有4种 | B、有3种 |
| C、有2种 | D、只有1种 |
如图是元素周期表的一部分,下列说法正确的是( )
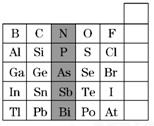

| A、阴影部分元素在周期表中处于第ⅣA族 |
| B、H3AsO4的酸性大于H3PO4 |
| C、元素铊(Tl)的最高价氧化物的水化物的碱性:Tl(OH)3<Al(OH)3 |
| D、元素砹(At)为有色固体,难与氢气化合 |
下列说法不正确的是( )
| A、副族元素次外层的d能级上的电子数均未达到10个 |
| B、短周期元素的内层电子均达到了饱和 |
| C、主族元素的次外层电子数为2个或8个或18个 |
| D、第三周期元素的次外层电子均为8个 |
目前世界各国都面临能源问题,现在人类直接利用的主要能源是( )
| A、太阳能 | B、核能 |
| C、氢能 | D、化石燃料 |
常温下pH<7的溶液一定是( )
| A、酸溶液 | B、碱溶液 |
| C、酸性溶液 | D、碱性溶液 |
下列说法中正确的是( )
| A、非金属单质燃烧时火焰均为无色 |
| B、所有金属及其化合物灼烧时火焰均有颜色 |
| C、焰色反应均应透过蓝色钴玻璃观察 |
| D、NaCl与Na2CO3灼烧时火焰颜色相同 |