题目内容
将9 g铜和铁的混合物投入100mL稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8 g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是 ( )
| A.原混合物中铜和铁各0.075mol |
| B.稀硝酸的物质的量浓度为0.5mol·L-1 |
| C.第一次剩余4.8g金属为铜和铁 |
| D.再加入上述100mL稀硝酸,又得到标准状况下1.12L NO |
A
第一次加硝酸时金属有剩余,无论参加反应的是铁还是铁和铜,溶解的4.2克金属均被氧化到+2价:3Fe(或3Cu)+8HNO3=3Fe(NO3)2[或3Cu(NO3)2]+2NO↑+4H2O,金属的物质的量为(1.12/22.4)×(3/2)="0.075mol" ,则第一次溶解的金属摩尔质量为56g·mol-1,是铁。第二次加硝酸后的溶液不能使KSCN溶液变红,溶解的4.8克金属也一定被氧化到+2价,同理可得其物质的量为0.075mol,金属摩尔质量为64g·mol-1,是铜。c(HNO3)=(1.12/22.4)×4/0.1
=2mol·L-1。若金属完全溶解后再加100mL稀硝酸,反应为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,经计算H+过量,生成的NO在标准状况下体积为0.075×(1/3)×22.4="0.56" L。故B、C、D错误,A正确。
=2mol·L-1。若金属完全溶解后再加100mL稀硝酸,反应为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,经计算H+过量,生成的NO在标准状况下体积为0.075×(1/3)×22.4="0.56" L。故B、C、D错误,A正确。

练习册系列答案
相关题目
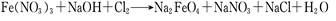


 ( )
( )