题目内容
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+==Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是 ( )
| A.反应中硫元素被氧化,所有铁元素均被还原 |
| B.氧化剂是Fe3+,氧化产物是Cu2+ |
| C.反应中转移电子的物质的量为x mol |
| D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x) mol |
D
试题分析:A、CuFeS2中铁元素的化合价为+2价,反应物Fe3+的化合价为+3价,生成物中Fe2+的化合价为+2价,所以不是所有铁元素均被还原,故A错误;B、依据反应中元素化合价的变化硫元素化合价从-2变化为0价被氧化为S,氧化产物是S,还原产物是Fe2+,铜离子反应前后化合价不变,所以氧化剂是Fe3+,氧化产物是S,故B错误;C、由CuFeS2+4Fe3+=Cu2++5Fe2++2S可知,生成2molS转移电子为4mol,则获得单质硫x mol转移电子为2x mol,故C不正确;D、由CuFeS2+4Fe3+==Cu2++5Fe2++2S,生成单质硫x mol时,生成
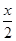 molCu2+
molCu2+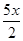 x molFe2+ 消耗2x molFe3+ ,余下(y mol-
x molFe2+ 消耗2x molFe3+ ,余下(y mol-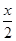 mol-
mol- 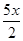 x mol)=(y-3x)molFe3+ ,则原Fe3+的总物质的量为(y-3x+2x) mol=(y-x) mol,D正确,选D。
x mol)=(y-3x)molFe3+ ,则原Fe3+的总物质的量为(y-3x+2x) mol=(y-x) mol,D正确,选D。
练习册系列答案
相关题目
 TiCl4+2CO。下列关于该反应的说法正确的是
TiCl4+2CO。下列关于该反应的说法正确的是 Fe3+。在过程A中,Fe2+作 剂。
Fe3+。在过程A中,Fe2+作 剂。