题目内容
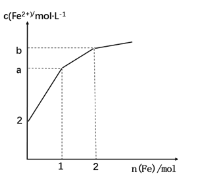
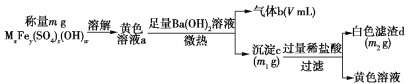
【题目】一种废水处理剂可表示为MxFey(SO4)z(OH)w,可按下列实验步骤确定其组成(气体体积在标准状况下测定):
下列有关叙述错误的是
A.检验a中是否含有Fe3+可用KSCN溶液
B.气体b能使湿润的红色石蕊试纸变蓝
C.加入稀盐酸的目的是溶解其中的氢氧化物
D.若V=448,m1=13.6,m2=9.32,可确定该化合物为NH4Fe3(SO4)2(OH)3
【答案】D
【解析】
A.根据Fe3+与SCN-生成血红色络合物判断;
B.加入碱并加热,产生的气体去氨气,根据氨气的水溶液显碱性分析;
C.盐溶液中加入Ba(OH)2产生的沉淀中含有难溶性金属氢氧化物;
D.V表示的是氨气的体积,可计算NH4+的物质的量,m1为BaSO4、Fe(OH)3质量和;m2为BaSO4的质量,可确定含有的NH4+、Fe3+、SO42-的物质的量,然后根据溶液呈电中性确定OH-的物质的量,它们的物质的量的比就是化学式在离子个数比,得化学式。
A. Fe3+与KSCN溶液反应,得到血红色溶液,A正确;
B.化合物与强碱反应生成气体,该气体为氨气,B正确;
C.由于加入的是强碱,产生的沉淀c一定是氢氧化铁和硫酸钡,而铁的氢氧化物溶于强酸,硫酸钡不能溶于强酸,C正确;
D.根据给出数据,可确定mg化合物中含有n(NH4+)=0.448L÷22.4L/mol=0.02mol,n(SO42-)=9.32g÷233g/mol=0.04mol,n(Fe3+)=n[Fe(OH)3]= (13.6g-9.32g)÷107g/mol=0.04mol,再根据溶液呈电中性可推知溶液中含有OH-的物质的量为n(OH-)=3n(Fe3+)+ n(NH4+)-2 n(SO42-)=0.04mol×3+0.02mol-0.04mol×2=0.06mol,n(NH4+):n(Fe3+):n(SO42-):n(OH-)=0.02:0.04:0.04:0.06=1:2:2:3,所以该化合物为NH4Fe2(SO4)2(OH)3,D错误;
故合理选项是D。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
IA | 0 | |||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是________(填元素符号。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是_________,其氢化物的电子式是_________。
(3)比较元素②、③的最高价氧化物对应水化物的酸性:______>______(填化学式)。说明你判断的理由:_________。
(4)主族元素砷(As)的部分信息如图所示。

①砷(As)在周期表中的位置是______。
②下列说法正确的是_______(填序号)。
a.砷元素的最高化合价为+4
b.推测砷有多种氧化物
c.③的气态氢化物的还原性大于砷的气态氢化物的还原性
(5)某小组同学设计实验比较VIIA元素的非金属性:Cl>Br>I。已知:常温下浓盐酸与高锰酸钾反应生成氯气。
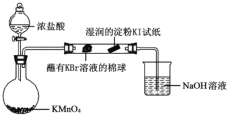
打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙红色,湿润的淀粉KI试纸变蓝,据此现象能否说明非金属性:Br >I,并说明理由_________。
【题目】下列实验过程可以达到实验目的的是
选项 | 实验目的 | 实验过程 |
A | 制备Fe(OH)胶体 | 将NaOH浓溶液滴加到饱和FeCl溶液中 |
B | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
C | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
D | 配制0.4000mol·L的NaOH溶液250mL | 称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立刻转移至250 mL容量瓶中定容 |
A.AB.BC.CD.D
【题目】下列有关实验的图示及分析均正确的是( )
选项 | 实验目的 | 实验图示 | 实验分析 |
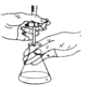
A | 实验室用酸性高锰酸钾溶液滴定草酸溶液 |
| 摇瓶时,使溶液向一个方向做圆运动,勿使瓶口接触到滴定管,溶液也不得溅出 |
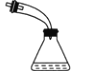
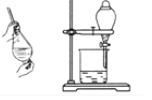
B | 石油分馏时接收馏出物 |
| 为收集到不同沸点范围的馏出物,需要不断更换锥形瓶 |
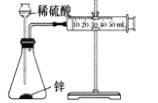
C | 测定锌与稀硫酸反应生成氢气的速率 |
| 实验中需测定的物理量是反应时间和生成氢气的体积 |
D | 用四氯化碳萃取碘水中的碘 |
| 充分震荡后静置,待溶液分层后,先把上层液体从上口倒出,再让下层液体从下口流出 |
A.AB.BC.CD.D
【题目】下表是元素周期表一部分,列出了九种元素在周期表中的位置:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
请用化学用语回答下列问题
(1)在上述元素中,金属性最强的是________。
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是________(填物质化学式)。写出⑥和⑧的最高价氧化物对应的水化物反应的离子方程式________。
(3)只由④形成的18电子微粒。________。
(4)写出②的最高价氧化物的电子式________。
(5)用电子式表示⑦和⑨形成的化合物的形成过程________。
<>(6)表中元素③和⑤可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式________。