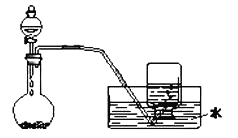
题目内容
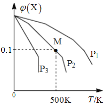
【题目】取 1LFeCl3 溶液腐蚀铜板制作电路板,反应后在此残留液中慢慢加入铁粉,溶液中 Fe2+的浓度变化如图所示(加入固体引起的体积变化忽略不计),下列说法错误的是
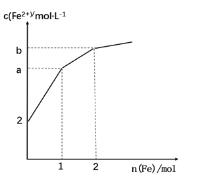
A.当n(Fe)=0.5mol 时,发生的离子反应为 Fe+2Fe3+=3Fe2+
B.当 n(Fe)=1.5mol 时,溶液中发生的总反应离子方程式为4Fe3++Cu2++3Fe=7Fe2++Cu
C.当n(Fe)=1mol 时,溶液中 c(Fe2+)=5 mol·L-1
D.腐蚀之前原溶液中n(Fe3+)=4 mol
【答案】D
【解析】
由于氧化性:Fe3+>Cu2+>H+,加入Fe在0mol到1mol时发生反应:Fe+2Fe3+=3Fe2+,加入Fe在1mol到2mol时发生反应:Fe+Cu2+=Cu+Fe2+,加入Fe大于2mol后发生反应:Fe+2H+=Fe2++H2↑。残留液中c(Fe2+)=2mol/L,残留液中加入1molFe将Fe3+消耗完毕,由Fe~2Fe3+可知,残留液中含有Fe3+为1mol×2=2mol。Cu2+完全反应消耗Fe消耗为2mol-1mol=1mol,由Fe~Cu2+可知残留液中Cu2+为1mol,由Cu+2Fe3+=Cu2++2Fe2+,可知Cu反应消耗为Fe3+为1mol×2=2mol,故原FeCl3溶液中FeCl3为2mol+2mol=4mol。
A.由上述分析可知,当n(Fe)=0.5mol时,发生的离子反应为Fe+2Fe3+=3Fe2+,故A正确;
B.由上述分析可知,当n(Fe)=1.5mol时,其中0.5molFe发生:Fe+Cu2+=Cu+Fe2+,反应的Fe、Fe3+、Cu2+分别为1.5mol、2mol、0.5mol,溶液中发生的总反应离子方程式为:4Fe3++Cu2++3Fe=7Fe2++Cu,故B正确;
C.由上述分析可知,当n(Fe)=1mol时,溶液中c(Fe2+)=![]() =5molL1,故C正确;
=5molL1,故C正确;
D.原FeCl3溶液中FeCl3浓度为![]() =4mol/L,由于Fe3+离子水解,故c(Fe3+)略小于4molL1,故D错误;
=4mol/L,由于Fe3+离子水解,故c(Fe3+)略小于4molL1,故D错误;
答案选D。

 阳光试卷单元测试卷系列答案
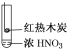
阳光试卷单元测试卷系列答案【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
I.CH2=CHCH3(g)+Cl2(g)![]() CH2ClCHClCH3(g) H1=-134kJ·mol1
CH2ClCHClCH3(g) H1=-134kJ·mol1
II.CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol1
CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol1
请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g)![]() CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol1,则该反应的活化能Ea(逆)为___________kJ·mol1。
CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol1,则该反应的活化能Ea(逆)为___________kJ·mol1。
(2)一定温度下,密闭容器中发生反应I和反应II,达到平衡后增大压强,CH2ClCHClCH3的产率____________(填“增大”“减小”或“不变”),理由是_____________________________。
(3)起始时向某恒容绝热容器中充入1mol CH2=CHCH3和1mol Cl2发生反应II,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
(4)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=__________kPa·min1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2ClCHClCH3)=__________kPa·min1。(保留小数点后2位)。
②该温度下,若平衡时HCl的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率____________;反应I的平衡常数Kp=____________________kPa1(Kp为以分压表示的平衡常数,保留小数点后2位)。