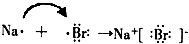题目内容
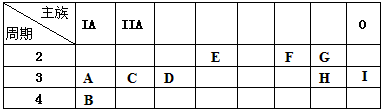
下表列出了A-I九种元素在周期表中的位置:| 主族 周期 | IA | IIA | ||||||
| 2 | E | F | G | |||||
| 3 | A | C | D | H | I | |||
| 4 | B |
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是______(填化学式)
(3)A、B、C、D按照原子原子半径由大到小的顺序排列为______(用元素符号排序).A与G可形成电子层结构相同的离子,这两种离子的半径由大到小排列为______(填化学式).
(4)F元素的氢化物有______、______,其中一种能与B的单质发生反应,请写出该反应的离子方程式______.
(5)这九种元素之间可以形成多种简单离子化合物和共价化合物,请写出其中一种的化学式______,并用电子式表示其形成过程:______.
【答案】分析:(1)从上到下,元素的金属性逐渐增强,从右到左,元素的金属性逐渐增强;
(2)同周期元素的原子,从左到右,元素的最高价氧化物对应的水化物的碱性逐渐减弱;
(3)电子层越多半径越大,同周期元素的原子,从左到右原子半径逐渐减小,核外电子排布相同的离子,质子数越多半径越小;
(4)氢元素的氧化物是水、双氧水,甲和水反应生成氢氧化钾和氢气;
(5)活泼金属和活泼非金属之间形成的化合物大多为离子化合物,非金属之间形成的化合物大多为共价化合物.
解答:解:根据元素在周期表中的位置,可以推知A为Na,B为K,C为Mg,D为Al,E为C,F为O,G为F,H为Cl,I为Ar.
(1)元素周期表中,从上到下,元素的金属性逐渐增强,从右到左,元素的金属性逐渐增强,所以金属性最强的金属在左下角,即为K,稀有气体元素的原子化学性质最不活泼,
故答案为:K;Ar;
(2)Na、Mg、Al是同周期元素的原子,从左到右,元素的最高价氧化物对应的水化物的碱性逐渐减弱,故碱性最强的是氢氧化钠,答案为:NaOH;
(3)K电子层最多,半径最大,Na、Mg、Al是同周期元素的原子,从左到右原子半径逐渐减小,即Na>Mg>Al,钠离子和氟离子具有相同的电子排布,质子数越多半径越小,即F->Na+,故答案为:K>Na>Mg>Al;F->Na+;
(4)氢元素的氧化物有水、双氧水,K和水反应生成氢氧化钾和氢气,故答案为:H2O;H2O2;2K+2H2O=2K++2OH-+H2↑;
(5)活泼金属和活泼非金属之间形成的化合物大多为离子化合物,用电子式表示NaCl形成过程为 ,
,
非金属之间形成的化合物大多为共价化合物,如H2O、HCl等,H2O中各原子达到稳定结构,用电子式表示形成过程为 ,
,
故答案为:NaCl(H2O); (
(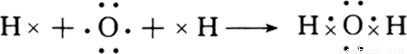 ).
).
点评:本题考查学生利用元素周期表和周期律解答,明确元素的位置判断元素是解答的突破,并利用金属性的比较、碱性强弱、原子半径大小比较等知识来解答即可,难度较大.
(2)同周期元素的原子,从左到右,元素的最高价氧化物对应的水化物的碱性逐渐减弱;
(3)电子层越多半径越大,同周期元素的原子,从左到右原子半径逐渐减小,核外电子排布相同的离子,质子数越多半径越小;
(4)氢元素的氧化物是水、双氧水,甲和水反应生成氢氧化钾和氢气;
(5)活泼金属和活泼非金属之间形成的化合物大多为离子化合物,非金属之间形成的化合物大多为共价化合物.
解答:解:根据元素在周期表中的位置,可以推知A为Na,B为K,C为Mg,D为Al,E为C,F为O,G为F,H为Cl,I为Ar.
(1)元素周期表中,从上到下,元素的金属性逐渐增强,从右到左,元素的金属性逐渐增强,所以金属性最强的金属在左下角,即为K,稀有气体元素的原子化学性质最不活泼,
故答案为:K;Ar;
(2)Na、Mg、Al是同周期元素的原子,从左到右,元素的最高价氧化物对应的水化物的碱性逐渐减弱,故碱性最强的是氢氧化钠,答案为:NaOH;
(3)K电子层最多,半径最大,Na、Mg、Al是同周期元素的原子,从左到右原子半径逐渐减小,即Na>Mg>Al,钠离子和氟离子具有相同的电子排布,质子数越多半径越小,即F->Na+,故答案为:K>Na>Mg>Al;F->Na+;
(4)氢元素的氧化物有水、双氧水,K和水反应生成氢氧化钾和氢气,故答案为:H2O;H2O2;2K+2H2O=2K++2OH-+H2↑;
(5)活泼金属和活泼非金属之间形成的化合物大多为离子化合物,用电子式表示NaCl形成过程为
 ,
,非金属之间形成的化合物大多为共价化合物,如H2O、HCl等,H2O中各原子达到稳定结构,用电子式表示形成过程为
 ,
,故答案为:NaCl(H2O);
 (
(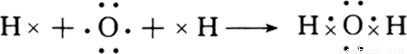 ).
).点评:本题考查学生利用元素周期表和周期律解答,明确元素的位置判断元素是解答的突破,并利用金属性的比较、碱性强弱、原子半径大小比较等知识来解答即可,难度较大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
 (
(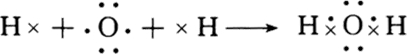 )
)