题目内容
常温条件下,将SO2气体通入一定量的NaOH溶液中,所得溶液呈中性,关于该溶液判断正确的是( )
| A、该溶液中的溶质为NaHSO3 |
| B、溶液中的离子浓度最大的是Na+ |
| C、溶液中C(Na+)=C(SO32-)+C(HSO3-) |
| D、该溶液的溶质为NaHSO3和NaOH |
考点:离子浓度大小的比较,二氧化硫的化学性质
专题:电离平衡与溶液的pH专题
分析:将SO2气体通入一定量NaOH溶液中,所得溶液呈中性,若反应生成Na2SO3,水解显碱性,则还生成NaHSO3,电离与水解的程度相等,结合物料守恒、电荷守恒解答.
解答:
解:A.若反应生成Na2SO3,水解显碱性,则还生成NaHSO3,电离与水解的程度相等,故A错误;
B.由电荷守恒可知c(Na+)=2c(SO32-)+c(HSO3-),则溶液中的离子浓度最大的是Na+,故B正确;
C.由电荷守恒可知c(Na+)=2c(SO32-)+c(HSO3-),故C错误;
D.由A的分析可知,溶质为Na2SO3、NaHSO3,NaHSO3和NaOH反应而不能共存,故D错误;
故选B.
B.由电荷守恒可知c(Na+)=2c(SO32-)+c(HSO3-),则溶液中的离子浓度最大的是Na+,故B正确;
C.由电荷守恒可知c(Na+)=2c(SO32-)+c(HSO3-),故C错误;
D.由A的分析可知,溶质为Na2SO3、NaHSO3,NaHSO3和NaOH反应而不能共存,故D错误;
故选B.
点评:本题以二氧化硫与碱的反应考查离子浓度的关系,注意溶液为中性时溶质判断为解答本题的关键,把握电荷守恒、物料守恒即可解答.

练习册系列答案
相关题目
锂~碘电池可用来为心脏起搏器提供能源,其电池反应可简化为:2Li+I2═2LiI.下列有关说法正确的是( )
| A、I2发生氧化反应 |
| B、碘电极为该电池的正极 |
| C、正极反应为:Li-e-=Li+ |
| D、该电池放电时化学能转化为电能 |
下列关于常见物质的说法中正确的是( )
| A、甲烷、苯、乙醇、乙酸在一定条件下都能发生取代反应 |
| B、乙烯使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色的原理相同 |
| C、油脂在酸性条件下水解为丙三醇和高级脂肪酸盐 |
| D、石油的分馏、硫酸铜晶体的风化、烧碱固体的潮解都属于物理变化 |
下列反应的离子方程式正确的是( )
| A、氯气与烧碱溶液反应:Cl2+H2O═Cl-+ClO-+2H+ |
| B、向氯化亚铁溶液中滴入氯水:2Fe2++Cl2═2Fe3++2Cl- |
| C、AlCl3溶液中加入过量的烧碱溶液:Al3++3OH-═Al(OH)3↓ |
| D、小苏打溶液中加入过量的澄清石灰水:Ca2++OH-+HCO3-═CaCO3↓+H2O |
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.Y与Z同周期、与X相邻周期,Z原子最外层电子数既是X原子内层电子数的3倍,也是Y原子最外层电子数的3倍.下列说法不正确的是( )
| A、X的最高价氧化物的水化物有强氧化性 |
| B、Y的单质着火时,不能用二氧化碳灭火 |
| C、Z的两种氧化物在常温下容易相互转化 |
| D、X、Z的氧化物是共价化合物,Y的氧化物是离子化合物 |
下列事实中,能说明HNO2是弱电解质的是( )
| A、用HNO2溶液做导电性实验,灯泡较暗 |
| B、HNO2是共价化合物 |
| C、HNO2溶液不与NaCl反应 |
| D、室温下,0.1mol?L-1 HNO2溶液的pH为2.15 |
在V mL Al2(SO4)3溶液中含有Al3+m g,取
mL该溶液用水稀释至4V mL,则SO42-物质的量浓度为( )
| V |
| 4 |
A、
| ||
B、
| ||
C、
| ||
D、
|
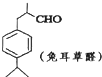
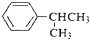 可写成
可写成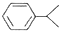
 ②
② 和
和 
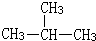 ⑤O2和O3 ⑥12C和14C
⑤O2和O3 ⑥12C和14C