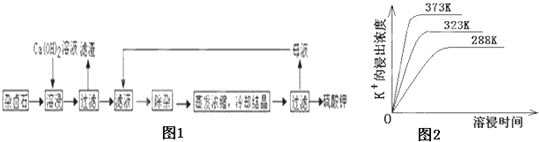
题目内容
【题目】CO、CO2是化石燃料燃烧后的主要产物。
(1)将体积比为2:1的CO2和CO混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃。将残留固体溶于水,所得溶液中2c(CO32-)+c(HCO3-)____________c(Na+)(填“>”“<”或“=”) 。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ/mol;键能E(o=o)=499.0 kJ/mol
①CO(g)+O2(g)![]() CO2(g)+O(g) 的△H=____________kJ/mol
CO2(g)+O(g) 的△H=____________kJ/mol
②已知2500K时,①中反应的平衡常数为0.40。某时刻该反应体系中各物质浓度满足: c(CO)·c(O2)=c(CO2)·c(O),则此时反应____________(填向左”或“向右”)进行。
(3)已知:反应CO2(g)![]() CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)
CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)![]() 2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2,
2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2, 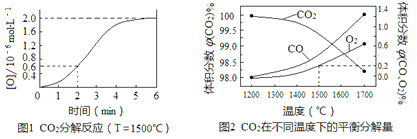
①分析图1,求2min内v(CO2)=_______。
②分析图2,1500℃时反应达平衡,此时容器体积为1 L,则反应的平衡常数K=______(计算结果保留1位小数)。
(4)为探究不同催化剂对CO和H2合成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1:3进行实验,得到如下数据:
选项 | T/K | 时间/min | 催化剂种类 | 甲醇的含量(%) |
A | 450 | 10 | CuO-ZnO | 78 |
B | 450 | 10 | CuO-ZnO-ZrO2 | 88 |
C | 450 | 10 | ZnO-ZrO2 | 46 |
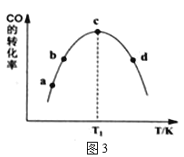
①由表1可知,该反应的最佳催化剂为____________(填编号);图3中a、b、c、d四点是该温度下CO的平衡转化率的是____________。
②有利于提高CO转化为CH3OH的平衡转化率的措施有____________。
A. 使用催化剂CuO-ZnO-ZrO2 B. 适当降低反应温度
C. 增大CO和H2的初始投料比 D. 恒容下,再充入a mol CO和3a mol H2
【答案】< -33.5 向左 3×10-7 mol/(Lmin) 3.2×10-8 mol/L B cd BD
【解析】
(1)碳酸钠在溶液中水解显碱性,结合溶液中电荷守恒分析;
(2)①根据盖斯定律,将已知的热化学方程式叠加,可得待求反应的热化学方程式;
②根据Qc与K的相对大小判断;
(3)①2min内O的浓度增大0.6×10-6 mol/L,则二氧化碳减小0.6×10-6mol/L,根据v(CO2)=![]() 计算;
计算;
②根据物质反应转化关系,计算平衡时各种物质的物质的量,利用体积比等于物质的量的比,结合K的含义计算;
(4)①表中数据可知,相同条件下甲醇的含量最高时催化剂效果最好,图2中a、b、c、d四点是该温度下CO平衡转化率的必须是平衡状态下的转化率;
②由CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-53.7 kJ/mol可知提高CO2转化为CH3OH平衡转化率,应使平衡向正向移动,可降低温度,增大浓度。
CH3OH(g)+H2O(g) △H1=-53.7 kJ/mol可知提高CO2转化为CH3OH平衡转化率,应使平衡向正向移动,可降低温度,增大浓度。
(1) Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,电火花不断引燃,发生反应:2CO+O2![]() 2CO2,整个过程相当于CO+Na2O2=Na2CO3,由于加入足量的Na2O2固体,则反应后的气体只能为O2,所以反应后生成物的化学式是Na2CO3、O2;Na2CO3在溶液中水解显碱性,则c(OH-)>c(H+)。溶液中电荷守恒为:2c(CO32-)+c(HCO3-)+c(OH-)=c(H+)+c(Na+),由于c(OH-)>c(H+),所以2c(CO32-)+c(HCO3-)<c(Na+);
2CO2,整个过程相当于CO+Na2O2=Na2CO3,由于加入足量的Na2O2固体,则反应后的气体只能为O2,所以反应后生成物的化学式是Na2CO3、O2;Na2CO3在溶液中水解显碱性,则c(OH-)>c(H+)。溶液中电荷守恒为:2c(CO32-)+c(HCO3-)+c(OH-)=c(H+)+c(Na+),由于c(OH-)>c(H+),所以2c(CO32-)+c(HCO3-)<c(Na+);
(2)①已知:(i)2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ/mol;
(ii)O2(g)=2O(g) △H=+499 kJ/mol;
根据盖斯定律:[(i)+ (ii)]÷2,整理可得:两个方程相加除以2即可得到CO(g)+O2(g)![]() CO2(g)+O(g) 的△H=-33.5 kJ/mol;
CO2(g)+O(g) 的△H=-33.5 kJ/mol;
②某时刻该反应体系中各物质浓度满足:c(CO)·c(O2)=c(CO2)·c(O),则Qc=![]() =1>K=0.40,则反应向左进行;
=1>K=0.40,则反应向左进行;
(3)①2min内O的浓度增大0.6×10-6 mol/L,则CO2的浓度减小0.6×10-6 mol/L,则v(CO2)=![]() =3×10-7 mol/(L·min);
=3×10-7 mol/(L·min);
②在反应开始时n(CO2)=1 mol,设生成的O2为x mol,则平衡时n(O2)=x mol,n(CO)=2x mol,n(CO2)=(1-2x) mol,由于平衡时,氧气的体积分数为0.2,则![]() =0.2,解得x=0.002,此时容器体积为1 L,则c(CO2) =0.996 mol/L,c(CO)=0.004 mol/L,c(O2)=0.002 mol/L,所以该反应的化学平衡常数K=
=0.2,解得x=0.002,此时容器体积为1 L,则c(CO2) =0.996 mol/L,c(CO)=0.004 mol/L,c(O2)=0.002 mol/L,所以该反应的化学平衡常数K=![]() mol/L≈3.2×10-8 mol/L;
mol/L≈3.2×10-8 mol/L;
(4)①表中数据可知,相同条件下甲醇的含量最高时催化剂效果最好,所以甲醇含量88%最高,催化剂CuO-ZnO-ZrO2最佳,故合理选项是B;
图3中a、b、c、d四点是该温度下CO平衡转化率的必须是平衡状态下的转化率,a、b点反应未达到平衡状态,不是平衡转化率,而c、d点是平衡转化率,故合理选项是cd;
②A.使用催化剂CuO-ZnO-ZrO2 加快反应速率,但不能使化学平衡发生移动,因此不能提高CO的平衡转化率,A错误;
B.该反应的正反应是放热反应,适当降低反应温度,可以使化学平衡正向移动,可增大反应物CO的转化率,B正确;
C.增大CO和H2的初始投料比,可增大H2的转化率,CO的转化率减小,C错误;
D.恒容下,再充入a molCO和3a mol H2,相当于增大压强,中的压强,化学平衡向气体体积减小的正反应方向移动,CO转化率增大,D正确;
故合理选项是BD。