题目内容
5.下列有关反应热的叙述中正确的是( )| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | X(g)+Y(g)?Z(g)+W(s)△H>0,升高温度,该反应的△H增大 | |
| C. | 已知:S(s)+O2(g)═SO2(g)△H1,S(g)+O2(g)═SO2(g)△H2 则△H1>△H2 | |
| D. | 甲中加入1 g SO2、1 g O2,乙中加入2 g SO2、2 g O2,在恒温恒容或恒温恒压下反应2SO2(g)+O2(g)?2SO3(g)达平衡时,乙放出的热量都等于甲的2倍 |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,氢气燃烧生成液态水;
B、反应热与反应物和生成物的总能量的相对大小有关;
C、等质量的同种物质,状态不同时具有的能量不同,气态具有的能量大于固态,则完全反应时气态放出的热量多,放热反应的△H为负值,放出的热量越多,△H越小;
D、恒温恒压下反应乙放出的热量都等于甲的2倍,但恒温恒容乙中压强变大,平衡正向移动,所以乙放出的热量大于甲的2倍.
解答 解:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,氢气燃烧生成液态水,由热化学方程式可知,氢气的燃烧热<-241.8kJ•mol-1,故A错误;
B、反应热与反应物和生成物的总能量的相对大小有关,而与外界条件无关,所以升高温度,该反应的△H不变,故B错误;
C、等质量的同种物质,状态不同时具有的能量不同,气态具有的能量大于固态,则完全反应时气态放出的热量多,则S(g)完全燃烧放出的热量比S(g)多,放热反应的△H为负值,放出的热量越多,△H越小,则△H1>△H2,故C正确;
D、恒温恒压下反应乙放出的热量都等于甲的2倍,但恒温恒容乙中压强变大,平衡正向移动,所以乙放出的热量大于甲的2倍,故D错误;
故选C.
点评 本题考查了反应热大小比较,题目难度不大,注意把握物质能量与状态的关系,注意放热反应中放出的热量越多△H越小.

练习册系列答案
相关题目
5.化学与环境、材料、信息、生活等关系密切,下列说法错误的是( )
| A. | 利用生物质能就是间接利用太阳能 | |
| B. | 地沟油经过加工处理后可用来制生物柴油和肥皂 | |
| C. | 高纯度的SiO2可以制成光电池将光能直接转化为电能 | |
| D. | “光化学烟雾”“硝酸型酸雨”的形成都与氮氧化合物有关 |
6.已知A、B、C、D、E为短周期中原子序数依次增大的元素,A元素的原子可以形成简单阳离子和简单阴离子,B的原子最外层电子数是其周期序数的2倍,A、B或A、B、C形成的某些化合物可与C的单质连续反应生成不同类别的物质,D为短周期中原子半径最大的元素,E的单质可用于计算机芯片的制造.下列说法不正确的是( )
| A. | A、B可以形成直线型化合物 | |
| B. | A、B、C三种元素形成的某些化合物可以再生 | |
| C. | A、B、C、D四种元素形成的化合物水溶液可能显酸性 | |
| D. | B的单质与C、E的化合物之间的反应一定是置换反应 |
3.下列叙述正确的是( )
| A. | 稀硫酸和铜粉反应可制备硫酸铜 | |
| B. | 碘化钾与浓硫酸反应可制备碘化氢 | |
| C. | 过氧化钠与二氧化碳反应可制备氧气 | |
| D. | 铝箔在氯气中燃烧可制备无水三氯化铝 |
10.某K2SO4和Al2(SO4)3的混合溶液,已知C(Al3+)=0.2mol/L,C(SO42-)=0.6mol/L,则K+的物质的量浓度为( )
| A. | 0.2mol/L | B. | 0.4mol/L | C. | 0.4mol/L | D. | 0.6mol/L |
17.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 放热反应在常温下一定很容易发生 | |
| C. | 反应放热还是吸热必须看反应物和生成物具有的总能量的相对大小 | |
| D. | 已知石墨(s)比金刚石(s)稳定,则石墨(s)转化为金刚石(s)要放出能量 |
14.实验是研究化学的基础.下列有关实验的说法正确的是( )
| A. | 用标准NaOH溶液滴定锥形瓶中的待测盐酸时,滴定前滴定管尖嘴处有气泡,滴定后气泡消失,会使结果偏高 | |
| B. | 测定氯水的pH,可使用玻璃棒蘸取溶液滴到pH试纸上,再立即与标准比色卡比对读数 | |
| C. | 检验Fe(NO3)2是否氧化变质:先加稀硫酸,再加KSCN溶液,观察溶液是否变红 | |
| D. | 可利用能否发生银镜反应鉴别甲醛和甲酸 |
15.a、b、c、d、e、f、g七种短周期元素在周期表中的位置如图所示.以下说法正确的是( )


| A. | a、b、f三种元素的最高价含氧酸均是强酸 | |
| B. | c、d、e三元素的最高价的水化物均是强碱 | |
| C. | a、b、f、g四种元素的氢化物的热稳定性逐渐增强 | |
| D. | e元素的单质既能与氢氧化钠溶液反应,又能与稀硫酸反应且均有氢气放出 |
 (乙基苄基醚),采用如下两条路线进行对比:
(乙基苄基醚),采用如下两条路线进行对比:
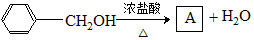


 、C2H5-O-C2H5.
、C2H5-O-C2H5. .
. +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$