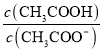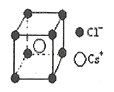题目内容
【题目】下表是甲、乙、丙、丁四种有机物的有关信息:
甲 | ①能使溴的四氯化碳溶液褪色; ②能与水在一定条件下反应生成丙; ③比例模型为 |
乙 | ①由C、H两种元素组成; ②比例模型为 |
丙 | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与丁反应生成相对分子质量为100的酯 |
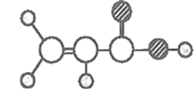
丁 | ①由C、H、O三种元素组成; ②球棍模型为 |
回答下列问题:
(1)甲与溴的四氯化碳溶液反应的生成物的结构简式是__。
(2)乙具有的性质是__(填序号)。
A.无色无味液体,有毒
B.不溶于水,密度比水的大
C.不能使酸性KMnO4溶液褪色
D.任何条件下不与氢气反应
(3)丙的官能团的名称:__;写出丙与Na反应的化学方程式:__。
(4)甲与氢气发生加成反应后生成物质戊,与戊在结构上相似的有机物有一大类(即“同系物”),它们均符合通式CnH2n+2。当n≥__时,这类有机物出现同分异构现象。
(5)丙与丁反应能生成相对分子质量为100的酯,该反应的反应类型为__;其化学方程式为___。
【答案】CH2BrCH2Br C 羟基 2C2H5OH+2Na→2C2H5ONa+H2↑ 4 酯化反应/取代反应 CH2=CH-COOH+C2H5OH![]() CH2=CH-COOC2H5+H2O
CH2=CH-COOC2H5+H2O
【解析】
比例模型为 能使溴的四氯化碳溶液褪色,则甲是乙烯CH2=CH2;甲能与水在一定条件下反应生成丙,则丙为CH3CH2OH;乙由C、H两种元素组成;比例模型为
能使溴的四氯化碳溶液褪色,则甲是乙烯CH2=CH2;甲能与水在一定条件下反应生成丙,则丙为CH3CH2OH;乙由C、H两种元素组成;比例模型为 ,则乙是C6H6;丁由C、H、O三种元素组成;球棍模型为
,则乙是C6H6;丁由C、H、O三种元素组成;球棍模型为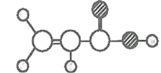 ,则丁是CH2=CH-COOH。
,则丁是CH2=CH-COOH。
(1)甲是乙烯,与溴的四氯化碳溶液反应的生成物的结构简式是:CH2BrCH2Br,故答案为:CH2BrCH2Br;
(2)乙是苯,苯为无色带有特殊气味的液体,有毒,故A错误;不溶于水,密度小于水,故B错误;和酸性高锰酸钾不反应,故C正确;在Ni的催化剂作用下可与H2发生加成反应,故D错误;故答案为:C;
(3)丙的CH3CH2OH,官能团的名称:羟基,乙醇与Na反应的化学方程式:2C2H5OH+2Na→2C2H5ONa+H2↑,故答案为:羟基;2C2H5OH+2Na→2C2H5ONa+H2↑;
(4)甲与氢气发生加成反应后生成物质戊,则戊为CH3CH3,戊的同系物中,当n≥4时,这类有机物出现同分异构现象,故答案为:4;
(5)丙是CH3CH2OH,丁是CH2=CH-COOH,两者反应能生成酯,该反应的反应类型为酯化反应或取代反应,化学方程式为:CH2=CH-COOH+C2H5OH![]() CH2=CH-COOC2H5+H2O,故答案为:酯化反应/取代反应;CH2=CH-COOH+C2H5OH
CH2=CH-COOC2H5+H2O,故答案为:酯化反应/取代反应;CH2=CH-COOH+C2H5OH![]() CH2=CH-COOC2H5+H2O。
CH2=CH-COOC2H5+H2O。

【题目】已知元素N、S、![]() 可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
(1)Se与S是同族元素,请写出基态Se原子的电子排布式:__。N与S是不同族元素,请解释NH3在水中的溶解度比H2S大的原因:__。
(2)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__。
(3)已知![]() 的结构为
的结构为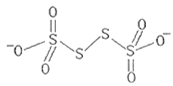 其中S原子的杂化方式是__。
其中S原子的杂化方式是__。
(4)N、P可分别形成多种三角锥形分子,已知NH3的键角大于PH3,原因是__。
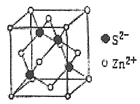
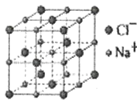
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
半径比 | 0.225~0.414 | 0.414~0.732 | 0.732~1 |
典型化学式 | 立方ZnS | NaCl | CsCl |
晶胞 |
|
|
|
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为__,晶体的密度为__g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。