题目内容
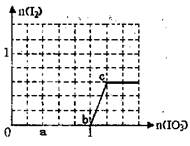
已知:还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法正确的是( )

| A.反应过程中的氧化产物均为SO3 |
| B.a点时剩余NaHSO3的物质的量为1.2 mol |
| C.b点时的还原产物可能是KI或NaI |
| D.当溶液中I-与I2的物质的量之比为1:1时,加入的KIO3为1.1 mol |
C
根据题干可得以下方程式:
IO3- + 3HSO3- = I- + 3SO42- + 3H+反应①
IO3- + 5I- + 6H+ =3I2 + 3H2O 反应②
从图中可知 0~b之间发生反应①,b~c之间发生反应②
a点IO3-为0.4 mol,参加反应的HSO3-为1.2 mol,剩余的NaHSO3的物质的量为1.8 mol;排除B;
b点处第一个反应恰好完成,还原产物是I-,可以以KI或NaI的形式存在,故符合题意;
整个反应过程中氧化产物有SO42-和I2,排除A项;
D项:设与I-反应的IO3- 的物质的量为x mol,则:
IO3- + 3HSO3- = I- + 3SO42- + 3H+反应①
1 1
IO3- + 5I- + 6H+ =3I2 + 3H2O 反应②
x 5x 3x
依题意,1-5x=3x,x = 1/8,此时共用KIO3是1+1/8="9/8" mol,排除D
故答案为C
IO3- + 3HSO3- = I- + 3SO42- + 3H+反应①
IO3- + 5I- + 6H+ =3I2 + 3H2O 反应②
从图中可知 0~b之间发生反应①,b~c之间发生反应②
a点IO3-为0.4 mol,参加反应的HSO3-为1.2 mol,剩余的NaHSO3的物质的量为1.8 mol;排除B;
b点处第一个反应恰好完成,还原产物是I-,可以以KI或NaI的形式存在,故符合题意;
整个反应过程中氧化产物有SO42-和I2,排除A项;
D项:设与I-反应的IO3- 的物质的量为x mol,则:
IO3- + 3HSO3- = I- + 3SO42- + 3H+反应①
1 1
IO3- + 5I- + 6H+ =3I2 + 3H2O 反应②
x 5x 3x
依题意,1-5x=3x,x = 1/8,此时共用KIO3是1+1/8="9/8" mol,排除D
故答案为C

练习册系列答案
相关题目
 2Cu+SO2下列说法正确的是 ( )
2Cu+SO2下列说法正确的是 ( ) 为________mL。
为________mL。 3:1
3:1