题目内容
【题目】某化学实验小组的同学为了探究SO2和氯水的漂白性,设计了如图实验装置。
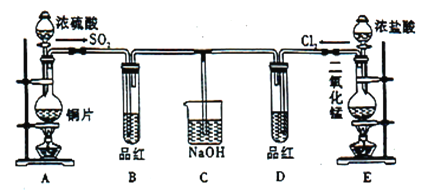
(1)写出A中反应的化学方程式__________,浓硫酸表现出__________性。
(2)实验室用装置E制备Cl2,离子方程式为_____________________________,生成标准状况下2.24 L气体时需要还原剂_________mol。
(3)①装置A中使用前需检漏的仪器是_________(填名称)。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:_______,D:______________。
【答案】Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O 氧化性和酸性 MnO2+4H++2C1-
CuSO4+SO2↑+2H2O 氧化性和酸性 MnO2+4H++2C1-![]() Mn2++Cl2↑+2H2O 0.2 分液漏斗 褪色的品红恢复红色 无明显现象
Mn2++Cl2↑+2H2O 0.2 分液漏斗 褪色的品红恢复红色 无明显现象
【解析】
(1)A中是铜与浓硫酸反应生成二氧化硫、硫酸铜和水,据此判断;
(2)实验室用二氧化锰与浓盐酸加热制备Cl2,结合反应的方程式解答;
(3)①带有玻璃活塞的仪器需要查漏;
②二氧化硫漂白后的物质具有不稳定性,而氯气的漂白具有不可逆性,据此判断。
(1)根据装置图可知,A中是铜与浓硫酸反应生成二氧化硫、硫酸铜和水,反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,在该反应中硫元素化合价降低,同时还有硫酸铜生成,因此浓硫酸既表现出氧化性又表现出酸性;
CuSO4+SO2↑+2H2O,在该反应中硫元素化合价降低,同时还有硫酸铜生成,因此浓硫酸既表现出氧化性又表现出酸性;
(2)实验室用装置E中二氧化锰与浓盐酸加热制备Cl2,同时生成氯化锰和水,反应的离子方程式为MnO2+4H++2C1-![]() Mn2++Cl2↑+2H2O。标况下2.24L氯气的物质的量是0.1mol,根据化合价的变化可知,该反应中氯化氢中的氯从-1价变为0价,所以该反应中的还原剂是HCl,因此根据氯原子守恒可知生成标准状况下2.24 L氯气时需要还原剂氯化氢的物质的量是0.2mol;
Mn2++Cl2↑+2H2O。标况下2.24L氯气的物质的量是0.1mol,根据化合价的变化可知,该反应中氯化氢中的氯从-1价变为0价,所以该反应中的还原剂是HCl,因此根据氯原子守恒可知生成标准状况下2.24 L氯气时需要还原剂氯化氢的物质的量是0.2mol;
(3)①装置A中盛放浓硫酸的仪器是分液漏斗,带有活塞,使用前需检查是否漏水;
②二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,加热也不能恢复红色,所以停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B中褪色的品红恢复红色,D中无明显现象。

【题目】有A、B、C、D、E、F六种前四周期元素,它们的原子序数依次增大。A、D同主族,A元素的原子最外层p能级的电子数等于次外层的电子总数,C原子最外层中有两个未成对的电子且与A同周期;C元素可分别与A、B、D、E生成RC2型化合物,并知EC2中E与C的质量比为1/1;F能形成红色(或砖红色)和黑色的两种氧化物。根据以上条件,回答下列问题:
(1)请写出F元素的名称 ___________F元素电子排布式___________________________
(2)在EC2分子中,E原子的杂化轨道类型为_________,分子的空间构型为 _______;
(3)H2E和H2C2的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
H2E | 187 | 202 | 2.6 |
H2C2 | 272 | 423 | 以任意比互溶 |
H2E和H2C2的相对分子质量基本相同,造成上述几种物理性质差异的主要原因 _____________ 。
(4)元素A的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 (_______________)
A.分子中含有分子间氢键 C.只含有4个sp-s的σ键和1个p-p的π键
B.属于含有极性键的非极性分子 D.该氢化物分子中A原子采用sp2杂化
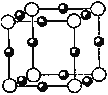
(5)B和F形成某种化合物的晶胞结构如右图所示(每个球均表示1个原子,其中B显-3价),则其化学式为 __________。F的常见离子和B的最简单氢化物形成的配离子的名称为___________,其水溶液颜色为________________。
![]()
【题目】芳香酸是分子中羧基与苯环直接相连的一类有机物,通常用芳香烃的氧化来制备。反应原理如下:

反应试剂、产物的物理常数:
名称 | 相对分子质量 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) | 水中的溶解性 |
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 |
主要实验装置和流程如下:

实验方法:一定量的甲苯和KMnO4溶液里于图l 装置中,在90℃时,反应一段时间后,
停止反应,按如下流程分离出苯甲酸并回收未反应的甲苯。

(1)白色固体B中主要成分的分子式为________。操作Ⅱ为________。
(2)如果滤液呈紫色,需加入亚硫酸氢钾,用离子方程式表示其原因__________。
(3)下列关于仪器的组装或者使用正确的是__________。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.如图 回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是上进下出
(4)除去残留在苯甲酸中的甲苯应先加入______,分液,然后再向水层中加入______,抽滤,洗涤,干燥即可得到苯甲酸。
(5)纯度测定:称取2.440g产品,配成100mL溶液,取其中25.00mL 溶液,进行滴定,消耗KOH物质的量为4.5×10-3mol。产品中苯甲酸质量分数为_______。