题目内容
a mol KMnO4和KClO3组成的混合物充分受热后,可生成标准状况下56 L氧气,求原混合物中高锰酸钾的物质的量。

这是一道有关混合物的计算题。KMnO4和KClO3分解都产生了氧气,只有搞清56 L氧气和KMnO4及KClO3的量之间的关系,才能顺利解答。
设KMnO4的物质的量为x,KClO3的物质的量为y。
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
2 mol 1 mol
x x
x
2KClO3 2KCl+3O2↑
2KCl+3O2↑
2 mol 3 mol
y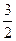 y
y
则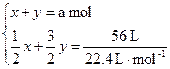
解得:x=
即原混合物中高锰酸钾的物质的量为 。
。
设KMnO4的物质的量为x,KClO3的物质的量为y。
2KMnO4
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑2 mol 1 mol
x
 x
x2KClO3
 2KCl+3O2↑
2KCl+3O2↑2 mol 3 mol
y
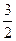 y
y则
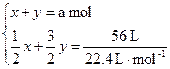
解得:x=

即原混合物中高锰酸钾的物质的量为
 。
。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
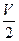 mL(相同状况),则原混合气体中CO和H2的体积比为( )
mL(相同状况),则原混合气体中CO和H2的体积比为( ) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O ∶1∶
∶1∶ ∶3∶1∶
∶3∶1∶ ∶1∶1
∶1∶1