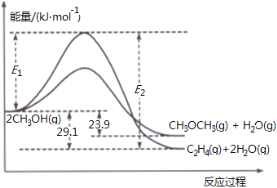
题目内容
【题目】(1)46 g NO2和N2O4的混合气体其分子数最多接近____________,氧原子数目为____________。
(2)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为____________,推断的依据为______________________。(填写定律的名称)
(3)有NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应:
①若所含溶质的物质的量相等,则生成沉淀的物质的量之比是________________;②若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量之比_____________。
(4)现将200mL0.01mol/LNaOH与50mL某浓度的Ca(OH)2溶液混合(混合后体积变化忽略不计),所得溶液中OH-的物质的量浓度是0.016mol/L,则Ca(OH)2溶液的物质的量浓度是 mol/L。
(5)现有标况下VL某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
①该气体所含原子数为____________。
②该气体溶于1L水中(不考虑反应),若所得的溶液的密度为d g·cm-3,其溶液中溶质的物质的量浓度为______ _ mol·L-1。
【答案】
(1)NA;2NA
(2)O3F2;阿伏伽德罗定律和质量守恒定律。
(3)① 1:2:3;② 6:3:2(4)0.02
(5)①![]() ;②
;②![]()
【解析】
试题分析:(1)存在平衡2NO2N2O4,只有NO2时含有分子数目最多,分子数最多接近为![]() ×6.02×1023mol-1=6.02×1023, NO2和N2O4混合气体中O元素质量分数为
×6.02×1023mol-1=6.02×1023, NO2和N2O4混合气体中O元素质量分数为![]() ,氧原子质量=46g×
,氧原子质量=46g×![]() =32g,O原子物质的量=
=32g,O原子物质的量=![]() =2mol,故含有O原子数目=2mol×6.02×1023mol-1=1.204×1024,故答案为:6.02×1023;1.204×1024;
=2mol,故含有O原子数目=2mol×6.02×1023mol-1=1.204×1024,故答案为:6.02×1023;1.204×1024;
(2) 根据质量守恒定律和阿伏加德罗定律,写出分解方程式为2OxFy![]() 3O2+2F2,则A化学式为O3F2.故答案为:O3F2;阿伏加德罗定律和质量守恒定律;
3O2+2F2,则A化学式为O3F2.故答案为:O3F2;阿伏加德罗定律和质量守恒定律;
(3) 反应的离子方程式为:Cl-+Ag+=AgCl↓,则有n(Cl-)=n(AgCl)NaCl、CaCl2、AlCl3三种溶液,若溶质的物质的量相等,则三种溶液中n(Cl-)的物质的量的比值为1:2:3,所以生成沉淀的物质的量之比为1:2:3;若生成的沉淀的质量相等,则NaCl、CaCl2、AlCl3三种溶液的n(Cl-)相等,所以:n(NaCl):n(CaCl2):n(AlCl3)=1:![]() :
:![]() =6:3:2,故答案为:①1:2:3;②6:3:2;
=6:3:2,故答案为:①1:2:3;②6:3:2;
(4) 混合前后OH-的物质的量不变,0.2L×0.01mol/L+0.05L×Xmol/L×2=0.016mol/L×(0.2+0.05)L,解得X=0.02mol/L,故答案为:0.02;
(5) ①气体物质的量为![]() =
=![]() mol,则含有原子数目为:
mol,则含有原子数目为:![]() mol×NAmol-1×2=
mol×NAmol-1×2=![]() ,故答案为:
,故答案为:![]() ;
;
(2)水的质量为1000mL×1g/mol=1000g![]() mol×Mg/mol)=(1000+
mol×Mg/mol)=(1000+![]() )g,则溶液体积为
)g,则溶液体积为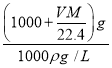 =
=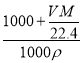 L,故所得溶液物质的量浓度为
L,故所得溶液物质的量浓度为 =
=![]() L,故答案为:
L,故答案为:![]() 。
。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料M gO: MgSO4(s)+ CO(g) ![]() MgO(s)+ CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+ CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |