题目内容
用惰性电极电解NaCl与NaHCO3的混合溶液,测得溶液的pH变化如图所示。
(1)在0→t1时间内,两个电极上的电极反应式为:
阳极:________________________________________________________________________;
阴极:________________________________________________________________________。
(2)用离子方程式表示0→t1时间内,溶液pH升高比较缓慢的原因:____________________________________________________________________________。
(1)2Cl--2e-=Cl2↑ 2H++2e-=H2↑
(2)HCO3-+OH-=CO32-+H2O
解析

练习册系列答案
相关题目
(1)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合 成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质.合成路线如下:
① 生产过程中,反应Ⅰ中需鼓入足量空气,试写出该反应的总方程式 。
② 反应Ⅱ中需要向溶液中加入适量的对苯二酚等物质(已知对苯二酚具有很强的还原性),其作用可能是 。
③ 反应Ⅲ中氧化剂与还原剂的物质的量之比为 。
④ 能用于测定尾气中SO2含量的是 。
| A.滴有酚酞的NaOH溶液 | B.酸性KMnO4 |
| C.滴有淀粉的碘水 | D.BaCl2溶液. |
负极:Pb-2e-+SO42-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.80L,电解前硫酸溶液浓度为4.50mol.L-1,当制得29.12 L Cl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)________ mol.L-1。
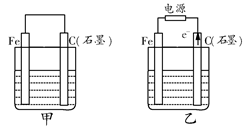
为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
| A.石墨 | B.镁 | C.银 | D.铂 |
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极溶液的pH (填“增大”“减小”或“不变”)
(4)电解过程中,Y极发生的电极反应为4OH?-4e?=2H2O+O2↑和 。
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为 mL(均已折算为标准状况时气体体积)。
(6)K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应为:
2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为 。