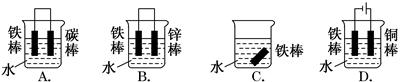
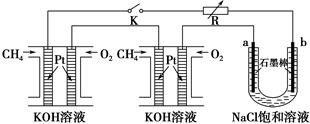
题目内容
如图甲、乙是电化学实验装置。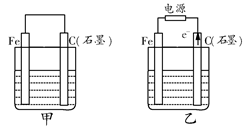
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液。
①甲中石墨棒上的电极反应式为__________________________________;
②乙中总反应的离子方程式为____________________________________;
③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。
若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为________________________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为____________________________________;
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入___________(填写物质的化学式)________g。
(1)①O2+2H2O+4e-=4OH-
②2Cl-+2H2O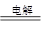 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
③5Cl2+I2+6H2O=10HCl+2HIO3
(2)①Fe-2e-=Fe2+
②CuO(或CuCO3) 0.8(或1.24)
解析

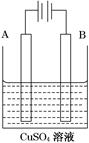
某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。
按照实验步骤依次回答下列问题:
(1)导线中电子流向为__________________(用a、b表示)。
(2)写出装置中锌电极上的电极反应式:____________________________________;
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________;(不许用“NA”表示)
(4)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
| A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动 |
| B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动 |
| C.盐桥中的K+、Cl-都向左侧烧杯移动 |
| D.盐桥中的K+、Cl-几乎都不移动 |