题目内容
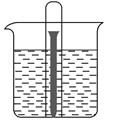
如图,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为_____________________________。
(2)B中Sn极的电极反应式为____________________________。
(3)C中被腐蚀的金属是________,总反应的化学方程式为_____________________。比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为__________。
(填序号)。
(1)Fe+2H+=Fe2++H2↑
(2)2H++2e-=H2↑
(3)Zn Zn+H2SO4=ZnSO4+H2↑ B>A>C
解析

某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。
按照实验步骤依次回答下列问题:
(1)导线中电子流向为__________________(用a、b表示)。
(2)写出装置中锌电极上的电极反应式:____________________________________;
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________;(不许用“NA”表示)
(4)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
| A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动 |
| B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动 |
| C.盐桥中的K+、Cl-都向左侧烧杯移动 |
| D.盐桥中的K+、Cl-几乎都不移动 |
为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如下图: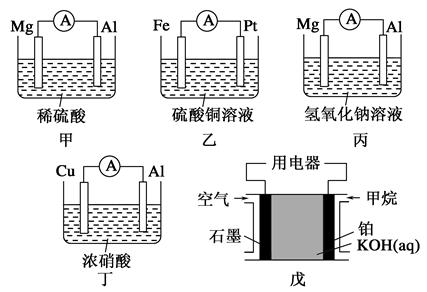
回答下列问题:
(1)根据原电池原理填写下表:
| 装置序号 | 正极 | 负极反应式 | 阳离子移动方向 |
| 甲 | | | |
| 乙 | | | |
| 丙 | | | |
| 丁 | | | |
| 戊 | | | |
(2)电极类型除与电极材料的性质有关外,还与________有关。
(3)根据上述电池分析,负极材料是否一定参加电极反应?_____
(填“是”“否”或“不一定”),请举例说明:__________________________________________。
(4)指出下列电池的放电过程中,电解质溶液酸碱性的变化:甲_______,丙_______,戊_______。(填酸性或碱性增强或减弱)
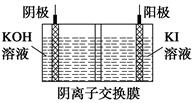
工业上采用的一种污水处理方法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。某科研小组用此法处理污水,设计装置示意图,如图所示。
(1)实验时若污水中离子浓度较小,导电能力较差,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
| A.BaSO4 | B.CH3CH2OH | C.Na2SO4 | D.NaOH |
①___________________________________________________;
②___________________________________________________。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是__________ ____。
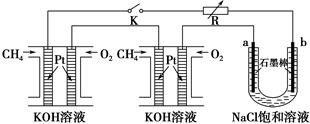
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。已知负极的电极反应是CH4 +4CO32--8e-=5CO2+2H2O。则正极的电极反应是 。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,此电池工作时必须有部分A物质参加循环,则A物质的化学式是_________。