题目内容
(如图表示常见元素单质及化合物相应关系,某些生成物略去
已知:反应①为氯碱工业的基础反应;X、Y为常见金属,Z为形成酸雨的主要成分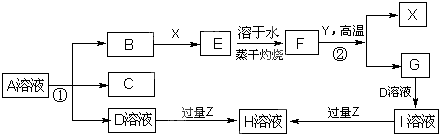
请回答下列问题:
(1)D的电子式______;H为______(填化学式)
(2)完成下列方程式
空气中含量最高的气体与C反应的化学反应方程式______;
反应②的化学反应方程式______;
足量B通入H溶液的离子反应方程式______.
解:反应①为氯碱工业的基础反应,D为NaOH,B为Cl2,C为H2,结合转化关系中的反应条件和反应特征可知,F何Y金属反应生成X金属,X、Y为常见金属,判断为铝热反应,X为Fe,E为FeCl3,F为Fe2O3,Y为Al,G为Al2O3 I为NaAlO2;Z为形成酸雨的主要成分为SO2,H为NaHSO3,
(1)D为NaOH电子式为: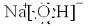 ,H为NaHSO3,故答案为:
,H为NaHSO3,故答案为: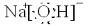 ;NaHSO3;
;NaHSO3;
(2)空气中含量最高的气体为N2与C(H2)反应的化学反应方程式为:N2+3H2 2NH3;
2NH3;
反应②为铝和氧化铁发生的铝热反应,反应的化学反应方程式为:2Al+Fe2O3 2Fe+Al2O3;
2Fe+Al2O3;
足量B(Cl2)通入H(NaHSO3)溶液中发生氧化还原反应,反应的离子反应方程式:Cl2+HSO3-+H2O=2Cl-+SO42-+3H+,
故答案为:N2+3H2 2NH3 ;2Al+Fe2O3
2NH3 ;2Al+Fe2O3 2Fe+Al2O3;Cl2+HSO3-+H2O=2Cl-+SO42-+3H+.
2Fe+Al2O3;Cl2+HSO3-+H2O=2Cl-+SO42-+3H+.
分析:反应①为氯碱工业的基础反应,D为NaOH,B为Cl2,结合转化关系中的反应条件和反应特征可知,F何Y金属反应生成X金属,X、Y为常见金属,判断为铝热反应,X为Fe,E为FeCl3,F为Fe2O3,Y为Al,G为Al2O3 I为NaAlO2;Z为形成酸雨的主要成分为SO2,H为NaHSO3,依据判断出的物质分析回答问题.
点评:本题考查了物质推断方法,物质转化关系的应用,物质性质的判断和反应条件的应用,电子式、离子方程式、化学方程式的书写,题目综合性较强.
(1)D为NaOH电子式为:
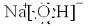 ,H为NaHSO3,故答案为:
,H为NaHSO3,故答案为: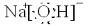 ;NaHSO3;
;NaHSO3;(2)空气中含量最高的气体为N2与C(H2)反应的化学反应方程式为:N2+3H2
 2NH3;
2NH3;反应②为铝和氧化铁发生的铝热反应,反应的化学反应方程式为:2Al+Fe2O3
 2Fe+Al2O3;
2Fe+Al2O3;足量B(Cl2)通入H(NaHSO3)溶液中发生氧化还原反应,反应的离子反应方程式:Cl2+HSO3-+H2O=2Cl-+SO42-+3H+,
故答案为:N2+3H2
 2NH3 ;2Al+Fe2O3
2NH3 ;2Al+Fe2O3 2Fe+Al2O3;Cl2+HSO3-+H2O=2Cl-+SO42-+3H+.
2Fe+Al2O3;Cl2+HSO3-+H2O=2Cl-+SO42-+3H+.分析:反应①为氯碱工业的基础反应,D为NaOH,B为Cl2,结合转化关系中的反应条件和反应特征可知,F何Y金属反应生成X金属,X、Y为常见金属,判断为铝热反应,X为Fe,E为FeCl3,F为Fe2O3,Y为Al,G为Al2O3 I为NaAlO2;Z为形成酸雨的主要成分为SO2,H为NaHSO3,依据判断出的物质分析回答问题.
点评:本题考查了物质推断方法,物质转化关系的应用,物质性质的判断和反应条件的应用,电子式、离子方程式、化学方程式的书写,题目综合性较强.

练习册系列答案
相关题目
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“