题目内容
【题目】1乙氧基萘是一种无色液体,密度比水的大,不溶于水,易溶于乙醇,熔点为5.5℃,沸点为267℃。1萘酚(性质与苯酚相似)的熔点为96℃,沸点为278℃,微溶于水,易溶于乙醇。乙醇的沸点为78.5℃。1乙氧基萘常用作香料,也可合成其他香料。实验室制备1乙氧基萘的反应原理如下:
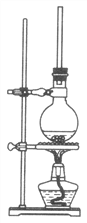

(1)将72g1萘酚溶于100mL无水乙醇中,再加入5mL浓硫酸。将混合溶液置于如图所示的圆底烧瓶中加热充分反应。实验中使用过量乙醇的原因是________。烧瓶上连接长玻璃管的主要作用是________________。
(2)反应结束后将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是________(填序号)。
A.③②④① B.①②③④ C.②①③④
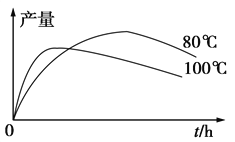
(3)实验测得1乙氧基萘的产量与反应时间、温度的关系如图所示,时间延长、温度升高,1乙氧基萘的产量下降的原因可能是__________、____________。
(4)某同学推测经提纯的产品可能还含有1萘酚、乙醇、硫酸和水等杂质,设计了如下方案进行检验,请完成表中内容。
实验目的 | 实验操作 | 预期现象和结论 |
①用金属钠检验1乙氧基萘是否纯净 | 取少量经提纯的产品于试管A中,加入金属钠 | 若_________,则产品纯净; 若__________,则产品不纯 |
②检验经提纯的产品是否含有1萘酚 | _______________ | 若_________,则含有1萘酚; 若_______________,则不含1萘酚 |
【答案】 提高1萘酚的转化率 冷凝回流,提高原料乙醇的利用率 A 1萘酚被氧化 温度高乙醇挥发较多(其他合理答案均可) 无气泡产生 有气泡产生(1分) 取少量实验所得的产品于试管中,加入1~2滴FeCl3溶液 溶液显紫色 溶液不显紫色
【解析】(1)首先,根据1—萘酚的熔沸点可知常温下是固体,由于它易溶于乙醇的性质,形成1—萘酚的乙醇溶液能加快反应速率,因此使用过量乙醇的原因是作溶剂;其次,乙醇过量,有利于1—萘酚转化,提高其转化率;虽然1—萘酚、1—乙氧基萘的沸点超过200℃,但是乙醇的沸点低于100℃,反应过程中乙醇容易变成蒸气逸出,导致1—萘酚的转化率降低,烧瓶上连接长直玻璃管的目的是冷凝回流,使乙醇蒸气变为乙醇液体,提高原料乙醇的利用率;(2)烧瓶中液体含有1—乙氧基萘、1—萘酚、乙醇、硫酸和水,倒入水中得到的有基层含有1—乙氧萘、1—萘酚、乙醇,由于酚类具有酸性,与NaOH溶液发生中和反应生成易溶于水的钠盐,而1—乙氧萘、乙醇都是非电解质,不能与NaOH溶液反应,因此先加入过量的NaOH溶液除去1—萘酚,再水洗并分液,得到的有机层含有1—乙氧萘、乙醇及少量水,然后用无水氯化钙除去水分,过滤所得滤液含有沸点相差较大的1—乙氧基萘、乙醇,最后用蒸馏法分离1—乙氧基萘、乙醇,可以得到纯净的1—乙氧基萘,故A正确;(3)由于酚类物质容易被空气中的氧气氧化,乙醇的沸点较低,因此反应时间延长,升高温度,导致1-萘酚被氧化,乙醇大量挥发(或乙醇等物质发生副反应),减少了反应物浓度,所以1—乙氧基萘的产率下降;(4)①1—乙氧基萘分子中无羟基,不能与Na反应,1—萘酚、乙醇、硫酸和水都能与Na发生置换反应,产生氢气;若取少量经提纯的产品于试管A中,加入金属钠,无气泡产生,则产品纯净;有气泡产生,则产品不纯;②1—萘酚含有羟基,且羟基与苯环直接相连,说明它属于酚类,性质与苯酚相似,由于苯酚可用浓溴水或氯化铁溶液检验;方案一:若取少量经提纯的产品于试管B中,滴入1~2滴FeCl3溶液,溶液显紫色,则含有1—萘酚;溶液不显紫色,则不含1—萘酚;方案二:若取少量经提纯的产品于试管B中,先加足量乙醇,振荡溶解,再滴入1~2滴浓溴水,产生白色沉淀,则含有1—萘酚;不产生白色沉淀,则不含1—萘酚。

【题目】将物质X逐渐加入Y溶液中,生成沉淀物质的量n2与所加X的物质的量n1的关系如图所示。符合图示情况的是
A | B | C | D | |
X | NaOH | AlCl3 | HCl | NaAlO2 |
Y | AlCl3 | NaOH | NaAlO2 | HCl |
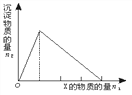
A. A B. B C. C D. D
【题目】硫元素的单质及其化合物在科学研究、工农业生产、农药的制备与使用等方面具有广泛用途。请
根据以下应用回答有关问题:
(1)己知单质硫有S2、S4、S6、S8、Sn等多种形式,在Sn分子内S原子以S—S单键形成“锯齿形”的n
元环。试画出S8的八元环结构式___________。
(2)绿色农药“石硫合剂”的有效成分为五硫化钙(CaS5)和硫代硫酸钙(CaS2O3),可由单质硫和熟石灰在加热条件下制得,该反应的化学方程式为(反应中单质硫要求用S4表示);____________。
己知多硫化钙为离子化合物,其中S原子以S—S单键连接成多硫链而形成—2价的原子团,试画出五硫化钙的电子式_________________。
(3)科学家探测出火星大气中含有一种称为硫化羰的物成,其化学式为COS,结构与二氧化碳分子相似。硫化羰可作为一种熏蒸剂,能防止某些昆虫、线虫的危害。请你利用下表中相关共价键的键能数据:
共价键 | C=O | C=S | H—O | H—S |
键能/kJ.mol-1 | 745 | 536 | 464 | 339 |
根据有关反应原理写出硫化羰气体与水蒸气反应生成CO2和H2S的热化学方程式:______________.
(4)S4广泛用于杀菌剂和抗真菌剂中,可由H2S2的燃料电池获得,其装置如下图所示。

①H2S2的名称是________。
②电极b为________ (选填“正极”、 “负极”)。
③电极a上发生的电极反应为:_______________。
(5)一氧化二硫(S2O)常温下是一种无色、不稳定的气体,实验室可由S8和氧化铜共热制得,同时生成硫化铜和SO2(注:生成物中气体产物等物质的量:升价与降价的硫也是等物质的量)。
该制备反应的化学方程式为________;
已知S2O常温时分解生成两种含硫的常见物质,请依据S2O中硫元索的价态分析并写出该分解反应的化学方程式_____________________。