题目内容
【题目】卤代烯烃是合成塑料的重要原料,研究合成卤代烯烃具有重要意义。T℃时,在10L的密闭容器中充入1mol2—丁炔(CH3—C≡C—CH3,可用X表示)和1molHCl,以Al2O3为催化剂发生如下反应:
Ⅰ.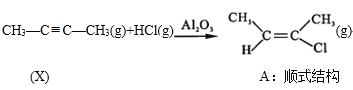 ΔH=akJ/mol(a<0)
ΔH=akJ/mol(a<0)
Ⅱ.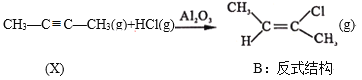 ΔH=bkJ/mol(b<0)
ΔH=bkJ/mol(b<0)
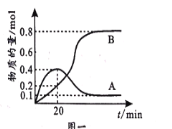
已知B比A更稳定,且产物A、B在混合物中的物质的量随时间变化如图一所示。试回答下列问题。
(1)发生反应I、Ⅱ的同时,还有反应A转化为B,且焓变为△H'。则△H'_0(填“>”、“<”或“=”)。
(2)①从反应开始至20min时生成B的平均速率v(B)=___;
②反应至20min时CH3—C≡C—CH3的转化率=__;
③在T℃时,反应I的平衡常数为__。
(3)T℃时,E1和E2分别代表反应I,Ⅱ的正反应活化能。
①由图一得出:E1__E2(填“>”、“<”或“;”);
②试从反应方向的角度分析,20min后A的物质的量减小的原因__。
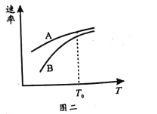
(4)其它条件相同时,测出生成A、B的速率随温度变化如图二所示,则提高B在较低温度下产率的措施是__。
【答案】< 1×10-3mol/(L·min) 60% 100 < B的能量低,A转化为B为放热反应,有利于A自发转化为B 加入低温下适合生成B的高性能催化剂
【解析】
根据盖斯定律,两式相减可得反应热;根据v=![]() 计算B表示的平均速率;
计算B表示的平均速率;
转化率=![]() ×100%;在T℃时,根据平衡时各物质的物质的量浓度计算反应I的平衡常数;其它条件相同时,相同温度下生成A、B 的速率不同,反应I、Ⅱ都使用催化剂,从催化剂的活性考虑提高B的生成速率的方法。
×100%;在T℃时,根据平衡时各物质的物质的量浓度计算反应I的平衡常数;其它条件相同时,相同温度下生成A、B 的速率不同,反应I、Ⅱ都使用催化剂,从催化剂的活性考虑提高B的生成速率的方法。
(1)已知:
Ⅰ.CH3-C≡C-CH3(g)+HCl(g)![]()
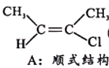 (g) H=akJ/mol(a<0)
(g) H=akJ/mol(a<0)
Ⅱ.CH3-C≡C-CH3(g)+HCl(g)![]()
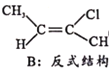 (g) H=bkJ/mol(b<0)
(g) H=bkJ/mol(b<0)
根据盖斯定律,Ⅱ-Ⅰ可得
![]()
 △H'=(b-a) kJ/mol,已知B比A更稳定,则反应Ⅱ放出的热量比反应I多,故b<a,(b-a)<0,即△H'<0,反应放热;
△H'=(b-a) kJ/mol,已知B比A更稳定,则反应Ⅱ放出的热量比反应I多,故b<a,(b-a)<0,即△H'<0,反应放热;
(2)①结合图示,从反应开始至20 min时生成B的物质的量为0.2mol,根据v=![]() ,v(B)=
,v(B)= =1×10-3mol/(Lmin);
=1×10-3mol/(Lmin);
②反应I、Ⅱ都在发生,反应至20 min时,根据图象,生成A、B的量分别为0.2mol、0.4mol,根据反应I、Ⅱ可得CH3-C≡C-CH3的消耗量为0.2mol+0.4mol=0.6mol,转化率=![]() ×100%=
×100%=![]() ×100%=60%;
×100%=60%;
③反应I的产物为A,在T℃时,根据图象,平衡时反应I生成A的物质的量为0.1mol,反应Ⅱ生成B的物质的量为0.8mol,则平衡时CH3-C≡C-CH3的物质的量为1mol-0.1mol-0.8=0.1mol,HCl的物质的量为1mol-0.1mol-0.8=0.1mol,反应I平衡常数K=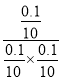 =100;
=100;
(3)①根据图象所示,20 min前,A的产量高于B,说明生成产物A的活化能较低,反应速率快,故E1<E2;
②根据B比A更稳定,说明B的能量低,A转化为B为放热反应,有利于A自发转化为B;
(4)相同温度下生成A、B 的速率不同,反应I、Ⅱ都使用催化剂,其它条件相同时,催化剂对反应I、Ⅱ生成A、span>B的催化效果不同,提高B在较低温度下产率的措施应为加入低温下适合生成B的高性能催化剂。